Gazlar
|
Maddenin gaz hali özellikle düşük basınç ve yüksek sıcaklıklarda moleküller arası etkileşmelerin en az olduğu veya hemen hemen etkileşmelerin bulunmadığı halidir. Gaz basıncı arttıkça gaz molekülleri arasındaki mesafeler azaldığından moleküller birbirlerini etkilemeye başlarlar. Genel olarak oda şartlarında (1 atm. ve 25 oC ) azot, oksijen, hidrojen gibi pekçok gaz için moleküller etkileşmeler çok düşüktür. Bu nedenle bu tür gazlar için oda şartları düşük basınç ve yüksek sıcaklık değerleri olarak düşünülebilir. Zaten gazlar ile ilgili yapılan ilk deneyler bu tür gazlar ile gerçekleştirilerek genel bazı gaz yasaları bulunmuştur. Maddenin en basit hali olan gaz halini incelerken önce saf haldeki gazları dikkate alacağız. Fakat saf haldeki gaz davranışları ile gaz karışımlarının davranışları arasında bir farklılık olmadığını göreceğiz. Gazları genel olarak kendi aralarında 2 gruba ayırabiliriz. Gazları davranılarına göre 2 grup altında inceleyebiliriz.
İdeal gaz kavramı düşük basınç ve yüksek sıcaklık değerlerinde genel gaz kanunlarına bağlı olan gazlar için kullanılır. Ancak hangi gaz olursa olsun yüksek basınç ve düşük sıcaklık değerlerine doğru gidildikçe ideal gaz davranışlarını bırakarak, genel gaz yasalarından sapmaya başlarlar. Böylece gerçek gaz davranışı göstermeye başlarlar. İdeal gaz teorik anlamda, hacmi olmayan veya bulundukları kap hacmi yanında kendi hacimleri ihmal edilebilecek, moleküller arası etkileşmeleri bulundurmayan gazdır. İdeal Gazların Hacimlerinin Basınca Bağımlılığı (Boyle Yasası)
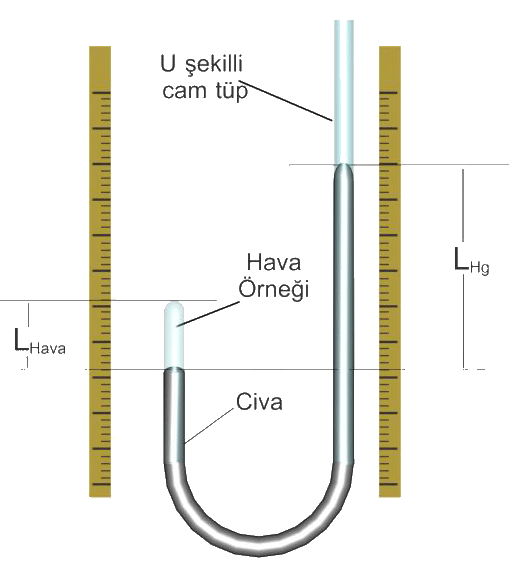
1660'lı yılların başlarında Robert Boyle bir miktar havanın hacmi üzerine basıncın etkisini araştırdı. Bunun için Boyle Şekil 2' dekine benzer bir düzenek kullandı. Bu düzenek bir ucu kapalı U şekillli bir cam borunun içerisine civa konularak hazırlanmıştı. Böylece bir miktar hava borunun bir ucunda hapsedilmişti. Böylece hapsedilmiş havanın basıncı, PHava, civanın uyguladığı basınç ile dış basıncın toplamına eşittir. Bu tür bir sistemde elde edilen P - V değerleri Tablo 1 deki gibidir. Boyle basınçın hacmin değerine bağlı olduğu ve bu ilişkinin \rm P \; \alpha \; 1/V şeklinde olduğunu göstermiştir. Eşitlik gazın belli miktarı ve sabit deney sıcaklığına bağlı olan k1 sabitine bağlı olarak \rm P = {k_1 \over V}
şeklinde verilebilir. k1 orantı katsayısının gazın cinsine de bağımlı olduğunu daha ileride açıklayacağız.
Farklı basınç ve sıcaklık değerleri için eşitliği \rm P_1V_1 = k_1 = P_2V_2 \text{ veya } {P_1 \over P_2 } = {V_2 \over V_1 }
şeklinde yazabiliriz.
Boyle yasasının ilk deneysel uygulaması 1626 yılında G.Baker ve H. S. Weather tarafından 0 oC ve 1 g azot gazı üzerinde denenmiştir. Bu deneyee ait bulgular Tablo 2 de gösterilmiştir.
Tablonun sonunda görüldüğü gibi PV değerleri birbirlerine çok yakın ve sabit sayılabilecek derecede birbirlerine yakındırlar. Bununla beraber yüksek basınç ve düşük sıcaklık değerlerinde Boyle Kanunu'ndan sapmalar meydana gelir. Bu tip bir deney 1869 yılında T. Andrews ve 1880 yılında E. Amagat yaptıkları deneylerde bu sapmaları göstermişlerdir (Tablo 3).
İdeal davranış gösteren sabit sıcaklıkta 12.0 atm. de 3.00 L. hacim kaplayan bir gazın basıncı 0.032 atm.'e düşerse kaplayacağı hacim ne kadar olur? |