Gazların Mol tartılarının Hesaplanması İçin Yöntemler
Buhar Yoğunluklarından Hareketle Mol Kütlesi Tayini ( Dumas
Yöntemi ):
Bu yöntem kolayca buharlaşabilen sıvıların mol tartılarının
belirlenmesinde yararlanılır. Yandaki şekilde görüldüğü gibi, ucundaki kapiler
yardımıyla sıvı ve buharın giriş ve çıkışını sağlayan birkaç cm3
lük hacime sahip baloncuk önce normal deney koşullarında havayla doldurularak
tartılarak mbhava büyüklüğü  belirlenir. Daha sonra baloncuk bir
su banyosunda hafifçe ısıtılarak, kapiler uç mol tartısı belirlenecek sıvıya
daldırılır. Böylece baloncuk soğurken mol tartısı belirlenecek madde
baloncuğa alınmış olur. Yeterince sıvı alındıktan sonra, balon sıvının kaynama
noktasında tutularak sıvının tümü buharlaştırılır. Kapiler borunun ucu
kapatılarak sıvı buharıyla dolu balon tartılarak mbsıvı
büyüklüğü belirlenir. Son olarak ısıtılarak çözünmüş gazı
uzaklaştırılmış suya daldırılan balonun kapiler kısmı kırılarak içerisine su
doldurulur ve suyunla dolu balonun kütlesi mbsu belirlenir. Tartma işleminin
yapıldığı labratuvar şartlarında su ve havanın yoğunluğu literatür
değerlerinden belirlenir. Suyun yoğunluğu dsu, havanın yoğunluğu dhava olmak üzere,
balon içerisindeki sıvı kütlesi, msıvı;
belirlenir. Daha sonra baloncuk bir
su banyosunda hafifçe ısıtılarak, kapiler uç mol tartısı belirlenecek sıvıya
daldırılır. Böylece baloncuk soğurken mol tartısı belirlenecek madde
baloncuğa alınmış olur. Yeterince sıvı alındıktan sonra, balon sıvının kaynama
noktasında tutularak sıvının tümü buharlaştırılır. Kapiler borunun ucu
kapatılarak sıvı buharıyla dolu balon tartılarak mbsıvı
büyüklüğü belirlenir. Son olarak ısıtılarak çözünmüş gazı
uzaklaştırılmış suya daldırılan balonun kapiler kısmı kırılarak içerisine su
doldurulur ve suyunla dolu balonun kütlesi mbsu belirlenir. Tartma işleminin
yapıldığı labratuvar şartlarında su ve havanın yoğunluğu literatür
değerlerinden belirlenir. Suyun yoğunluğu dsu, havanın yoğunluğu dhava olmak üzere,
balon içerisindeki sıvı kütlesi, msıvı;
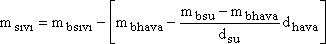
bağıntısından belirlenebilir. Balon ve balon içindeki gazın
hacmi;
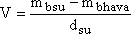
eşitliğinden belirlenebilir. msıvı, V, P, T büyüklükleri
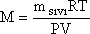
bağıntısında yerine konularak uçucu sıvıya ilişkin M mol tartısı
belirlenir.
Victor Mayer Yöntemiyle Mol Kütlesi Tayini :
Bu yöntem ilk defa 1878 yılında Zürich Üniversitesi Profesörlerinden
Victor Mayer tarafından bulunmuştur. Dumas yöntemi parelelinde, uçucu sıvıların mol
tartılarını belirlemek amacı ile kullanılır. Tartısı bilinen uçucu bir sıvının
hacminin ölçülmesi ilkesine dayanır. Bu hacim ise; buharlaşan sıvı ile yer
değiştiren aynı hacimdeki havayı oda sıcaklığındaki bir gaz büretindeki su
üstüne toplama ilkesine dayanarak ölçülür. Büret içindeki gazın basıncı
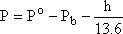
eşitliğinden elde edilir. Burada Po; barometreden okunan mm-Hg
cinsinden basınç, Pb; suyun deney şartlarındaki buhar basıncı; h; cm
olarak gaz büretindeki su yüksekliğidir.13.6 sabit değeri ise g cm-3 olarak
civanın yoğunluğunu gösterir. Yöntemi kullanarak duyarlık sonuçlar elde edilmek
istenirse gerçek gazlarla ilgili hal denklemlerinin işleme sokulması gerekir. Bu
amaçla eğer gazın a ve b van der Walls sabitleri biliniyorsa, van der Walls hal
denklemi kullanılabilir. Bertholet Denklemi kullanılacak olursa tablolarda verilen kritik basınç ve
sıcaklık değerleri gerekli olacaktır. Gerçek gazın mol sayısı m/M olarak
alınırsa ve gazın yoğunluğu d = m/V dönüşümü yapılırsa;
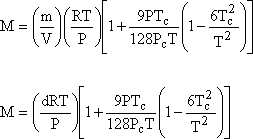
yazılabilir. Kaynama noktası suyun kaynama noktasından en az 20 oC
daha düşük sıvılar için Victor Mayer Yöntemi, Bertholet hal Eşitliği
kullanılarak oldukça uygun sonuçlar vermektedir.
Gerçek gazların düşük basınçlarda ideal gaz davranışı
gösterdiklerinden daha önce söz etmiştik. P basıncının limit durumda sıfıra
gitmesi halinde gaz tamamen ideal halde bulunacaktır ki bu durumda gerçek gazların mol
tartıları ideal hal denkleminden yararlanılarak hesaplanabilir. Bu amaçla gaz veya
sıvı buharının yoğunlukları belirli ve istenen sıcaklıkta 1 atmosferden itibaren
düşürülerek yeterli sayıda ölçüm alınır. d/P = f(P) değişim eğrisi
oluşturulduğunda eğer gaz idallik gösteriyorsa belirli sıcaklık için
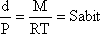
sabit olacağından d/P = f(P) eğirisi P eksenine parelel konum
gösterecektir. Gaz gerçek gaz davranışı göstermeğe başladığında bu değer
sabir olmayacaktır. Bu nedenle elde edilen eğrinin ektrapolasyon değerinin ideal gaz
gibi davrandığı basınç değerinin belirlenmesi gerekir. Bu matematiksel olarak;
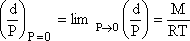
şeklinde gösterilebilir.
 belirlenir. Daha sonra baloncuk bir
su banyosunda hafifçe ısıtılarak, kapiler uç mol tartısı belirlenecek sıvıya
daldırılır. Böylece baloncuk soğurken mol tartısı belirlenecek madde
baloncuğa alınmış olur. Yeterince sıvı alındıktan sonra, balon sıvının kaynama
noktasında tutularak sıvının tümü buharlaştırılır. Kapiler borunun ucu
kapatılarak sıvı buharıyla dolu balon tartılarak mbsıvı
büyüklüğü belirlenir. Son olarak ısıtılarak çözünmüş gazı
uzaklaştırılmış suya daldırılan balonun kapiler kısmı kırılarak içerisine su
doldurulur ve suyunla dolu balonun kütlesi mbsu belirlenir. Tartma işleminin
yapıldığı labratuvar şartlarında su ve havanın yoğunluğu literatür
değerlerinden belirlenir. Suyun yoğunluğu dsu, havanın yoğunluğu dhava olmak üzere,
balon içerisindeki sıvı kütlesi, msıvı;
belirlenir. Daha sonra baloncuk bir
su banyosunda hafifçe ısıtılarak, kapiler uç mol tartısı belirlenecek sıvıya
daldırılır. Böylece baloncuk soğurken mol tartısı belirlenecek madde
baloncuğa alınmış olur. Yeterince sıvı alındıktan sonra, balon sıvının kaynama
noktasında tutularak sıvının tümü buharlaştırılır. Kapiler borunun ucu
kapatılarak sıvı buharıyla dolu balon tartılarak mbsıvı
büyüklüğü belirlenir. Son olarak ısıtılarak çözünmüş gazı
uzaklaştırılmış suya daldırılan balonun kapiler kısmı kırılarak içerisine su
doldurulur ve suyunla dolu balonun kütlesi mbsu belirlenir. Tartma işleminin
yapıldığı labratuvar şartlarında su ve havanın yoğunluğu literatür
değerlerinden belirlenir. Suyun yoğunluğu dsu, havanın yoğunluğu dhava olmak üzere,
balon içerisindeki sıvı kütlesi, msıvı;