Buraya kadar gazların fiziksel davranışlarına ilişkin deneysel çalışmaları gördük. Bununla beraber gaz kanunlarının neden geçerlidir veya neden gazlar ideal davranışlardan sapma gösterirler sorularına ilişkin olarak herhnagi bir cevap veremeyiz. Bu kısımda; gazların bu davranışlarının nedenleri konusunu açıklayabilmek için teorik bazı yaklaşımlardan yararlanacağız. Bunun için gazlara moleküler dünyadan bakmamız gerekir. Maddenin moleküler kavramı gazların moleküler davranışını da açıklayabilir. Bu yaklaşım Gazların Kinetik-Moleküler Teorisi olarak bilinir. 1800 yıllarda Ludwig Boltzmann, James Clerk Maxwell ve R. J. E. Clausius teorinin geliştirilmesi için çalışmışlardır. Geliştirilen teori için postülatlar
Gazlar moleküler olarak adlandırılan taneciklerden oluşur. ve belirli bir gazın molekülleri tamamen birbirine özdeştir. Farklı gazlara ilişkin moleküller ise farklı kütle ve boyuttadır.
Kap içindeki gaz moleküleri ortamın sıcaklığına da bağımlı olarak sürekli ve tamamen gelişigüzel hareket ederler.
Gaz moleküllerinin gerek kendi aralarında gerekse kabın cidarı ile yaptıkları çarpışmalar tamamen esnektir. Gaz molekülerinin cidarla çarpışmaları sonucu basınç olarak bilinen olay ortaya çıkmaktadır. Basınç, gaz moleküllerinin birim yüzeye uyguladıkları kuvvettir.
Kap içindeki gaz moleküllerinin sabit sıcaklıktaki basınçları zamanla değişim göstermez, moleküller çarpışmaları sırasında sürtünme kuvvetleriyle karşılaşmazlar. Böylece hareket enerjileri kayba uğramaz.
Gaz ortamdaki molekülerin kinetik enerjileri ortamın mutlak sıcaklığı ile doğru orantılıdır.
Düşük basınçlarda gaz moleküleri arasındaki mesafeler, molekül çaplarına oranla çok fazladır. Böylece moleküller arasındaki uzaklığın karesiyle ters orantılı olarak değişen moleküller arası çekim kuvveti ihmal edilebilecek kadar düşük değerdedir.
Gaz molekülerinin kendi hacimleri, işgal ettikleri kabın hacmine oranla çok küçüktür ve hesaplamalarda ihmal edilebilir.
şeklindedir.
Kinetik teorinin matematiksel analizi için; m; molekül
kütleli, ve u; hızına sahip n' tane gaz molekülünün kübik
bir hacim içinde
olduğunu düşünelim. Üç eksen doğrultusunda eşit olasılıkla hareket eden
taneciğin hız bileşenleri ux, uy
ve uz olsun. Molekülün bileşke hızı ise;
![]()
eşitliği ile verilebilir. u hızı hız kareleri ortalamalı hızı olarak adlandırılır. yz düzleminde ve x ekseni doğrultusunda bir tek gaz molekülü taneciğinin çepere çarparak sahip olabileceği momentum değişimi, elestik çarpma sonucu - ux hızıyla geri döneceği için;
![]()
olacaktır. kübün bir kenar uzunluğu L ise, bir saniyede ux/2L defa x ekseni tarafındaki sağ yüzeye çarpacak olan gaz molekülünün momentum değişimi
![]()
olacaktır. Aynı gaz molekülü için x ekseni doğrultusundaki zıt yz
yüzeyinde de momentum değişimi olacağından, x ekseni doğrultusundaki bir molekülün
birim saniyedeki momentum değişimi ![]() olacaktır. y ve z eksen
doğrultusundaki momentum değişimleri de sırasıyla
olacaktır. y ve z eksen
doğrultusundaki momentum değişimleri de sırasıyla ![]() ve
ve ![]() olacaktır. Bu nedenle tek bir molekül
için üç eksen boyunca saniyedeki momentum değişimi için
olacaktır. Bu nedenle tek bir molekül
için üç eksen boyunca saniyedeki momentum değişimi için
![]()
yazılabilir. Kab içindeki molekül sayısı n' olduğundan bir saniyede
toplam momentum değişimi ![]() olacaktır. momentum değişim hızı F kuvvetini oluşturduğundan, birim yüzeye etkiyen
kuvvet, basınç olarak aşağıdaki bağıntı ile verilebilir.
olacaktır. momentum değişim hızı F kuvvetini oluşturduğundan, birim yüzeye etkiyen
kuvvet, basınç olarak aşağıdaki bağıntı ile verilebilir.
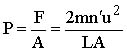
Burada A toplam yüzey ve P basınçtır. Kübik bir yapının toplam yüzeyi A=6L2 olacağından, basınç;
![]()
ifadesi ile verilebilir. Kübün hacmi V=L3 olduğundan son eşitlik için
![]() ve
ve ![]()
bağıntıları yazılabilir. Bu sonuç kinetik teorinin temel ifadesidir.
KAYNAKLAR :