Birbiri İle Kısmen Karışan SıvılarBirbiri ile kısmen karışan sıvılar, birbiri içinde az miktarda çözünebilen sıvılardır. Örneğin A sıvısı içerisinde B sıvının çözünürlüğü düşükse, A sıvısına çok az miktarda B eklendiğinde A içinde çözünür. A çözücüsü B sıvısına doyduğunda, daha fazla B eklendiğinde ikinci bir faz oluşturur. Tersi durumda, yani B sıvısına çok az miktarda A sıvısı eklendiğinde, A sıvısı B sıvısında çözünür. B sıvısına yeterince A eklendiğinde B sıvısı da A sıvısına doyar, daha fazla A eklenirse A sıvısı bir faz olarak ayrılır. Sonuç olarak kısmen B sıvısı A sıvısı içerisinde kısmen çözünürken, A sıvısı da B içerisinde kısmen çözünür. Bu tür karışımların birbiri içinde karışma miktarları sıcaklığa bağlı olarak değişir. Bu karışımları;
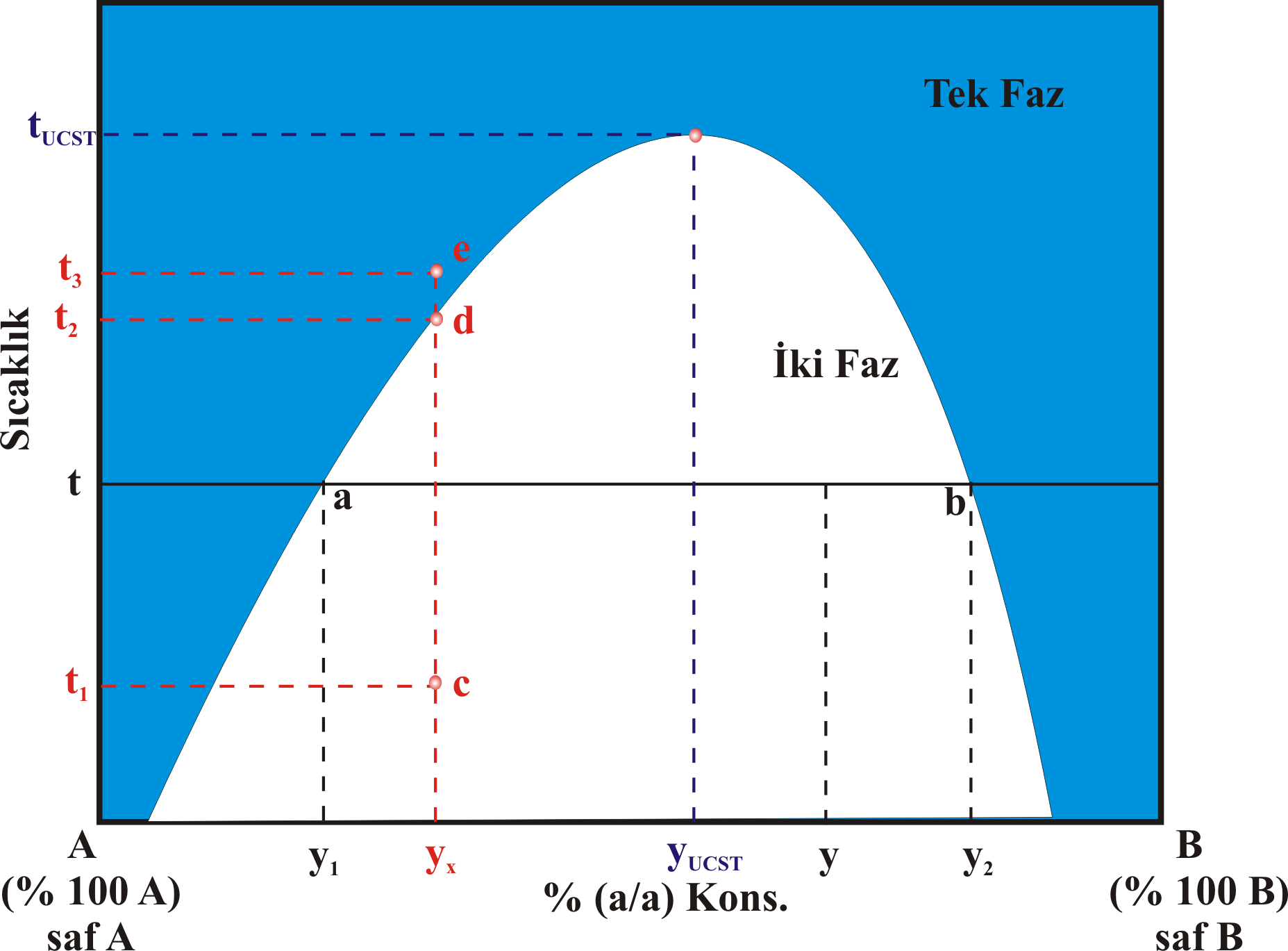
olarak gruplandırabiliriz. (1). Üst Kritik Çözünme Sıcaklığına Sahip Karışımlar Bu karışımların bileşim-sıcaklık grafiği Şekil 1 de görüldüğü gibidir. Bazı bileşim ve sıcaklıklarda sistem tek fazlı iken, bazı bileşim ve sıcaklıklarda ise 2 fazlıdır. Örneğin \rm y_x \; ve \; t_1 sıcaklığında sistem c noktasında olup iki fazlıdır. \rm y_x \; ve \; t_1 sıcaklığındaki karışımın sıcaklığı arttırılırsa, sıcaklık \rm t_2 değerine ulaştığında kritik bir noktaya ulaşılır. Sıcaklık biraz daha arttırılırsa karışım tek fazlı hale gelecektir. \rm t_3 sıcaklıklığına ulaşan karışımda tek fazlıdır. bu sıcaklığın üstündeki sıcaklıklarda sistem tek fazlıdır.
\rm y_x \; ve \; t_3 sıcaklığında e noktasında bulunan karışım yavaşça soğutulursa, tekrar \rm t_2 sıcaklığında kritik nokta olan d noktasına ulaşılır. Bu noktanın hemen altında karışım yeniden iki fazlı hale gelecektir. Ancak bu geçiş sırasında iki faz birbirindan aniden ayrılmaz. Bu örnekte B daha az olduğudan A içinde dağılacaktır. Bu dağılma öncesinde homojen ve berrak olan tek fazlı karışım, B nin A içinde gözle görülmez kürecikler şeklinde ayrılırken, karışımın bulanıklaştığı görülür. Bu bulanıklaşmanın görüldüğü noktaya bulutlanma noktası adı verilir. Bulutlanmanın oluşup kaybolduğu nokta ne kadar iyi tespit edilirse, \rm y_x bileşimindeki karışım için kritik nokta olan \rm t_2 sıcaklığı kadar hassas olarak belirlenebilir. t sıcaklığıda bulunan A içine sıcaklığı değişmeden çok az miktarda B eklendiğinde, A içerisinde B çözünür ve sistem tek fazlı olur. Karışıma t sıcaklığı değişmeksizin B eklenmeye devam edildiğinde, karışım içindeki B miktarı \rm y_1 değerine, a noktasına ulaşır. Bu nokta A nın B doyduğu noktadır. Bundan sonra eklenen B ikinci bir faz oluşturacaktır. Benzer şeyler B fazına A eklenmesi içinde söylenebilir. t sıcaklığındaki B ye sıcaklığı değişmeksizin çok az miktarda A eklenirse A, B fazı içerisinde çözünür. t sıcaklığıdaki bu karışıma daha fazla A eklenecek olursa, B nin konsantrasyonu \rm y_2 değerine kadar geriler. Bu noktada; B, A ya doymuştur. Daha fazla A eklenecek olursa; A, B içinde dağılır. Sonuç olarak; A ve B sıvıları iki fazlı B nin karışım içindeki konsantrasyonunun y olduğu bir sistem oluşturduklarında; A fazında çözünmüş olarak B bulunur ve A fazındaki B nin konsantrasyonu \rm y_2 dir. Diğer taraftan B fazının içinde de A çözünmüş olarak bulunur ve bu nedenle B fazındaki B konsantrasyonu \rm y_2 dir. Bir Arada Bulunan Fazların Miktarı : Kaldıraç Kuralı Şekil 1 de görülen t sıcaklığıda ve y bileşimindeki sistemdeki herbir fazın kütlesinin ne kadar olduğunu hesaplayalım. A fazında B çözündüğü için; A fazının kütlesini \rm m_{A(B)} olarak, B fazında A çözündüğü için; B fazının kütlesini \rm m_{B(A)} olarak gösterirsek sistemin toplam kütlesi \rm m_T ; \rm m_T = m_{A(B)} + m_{B(A)}
olacaktır. B bileşeninin \rm m_T ağırlığındaki toplam kütlesi; \rm y(m_T), A fazındaki B nin kütlesi \rm y_1 m_{A(B)}, B fazındaki B nin kütlesi; \rm y_2 m_{B(A)} olacağından; \rm y(m_T) = y_1 m_{A(B)} + y_2 m_{B(A)}
\rm y \big( m_{A(B)} + m_{B(A)} \big) = y_1 m_{A(B)} + y_2 m_{B(A)}
yazılabileceğinden \rm { m_{A(B)} \over m_{B(A)} } = { y_2 - y \over y - y_1}
elde edilebilir. Bu eşitlik dengede bulunan A ve B fazlarının oranını bulmak için kullanılır. Bu kural kaldıraç kuralı olarak adlandırılır.
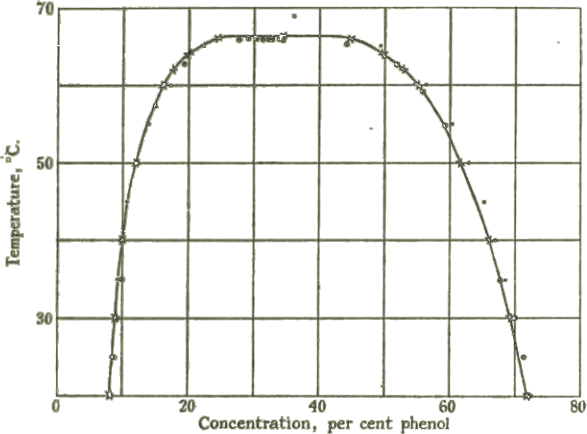
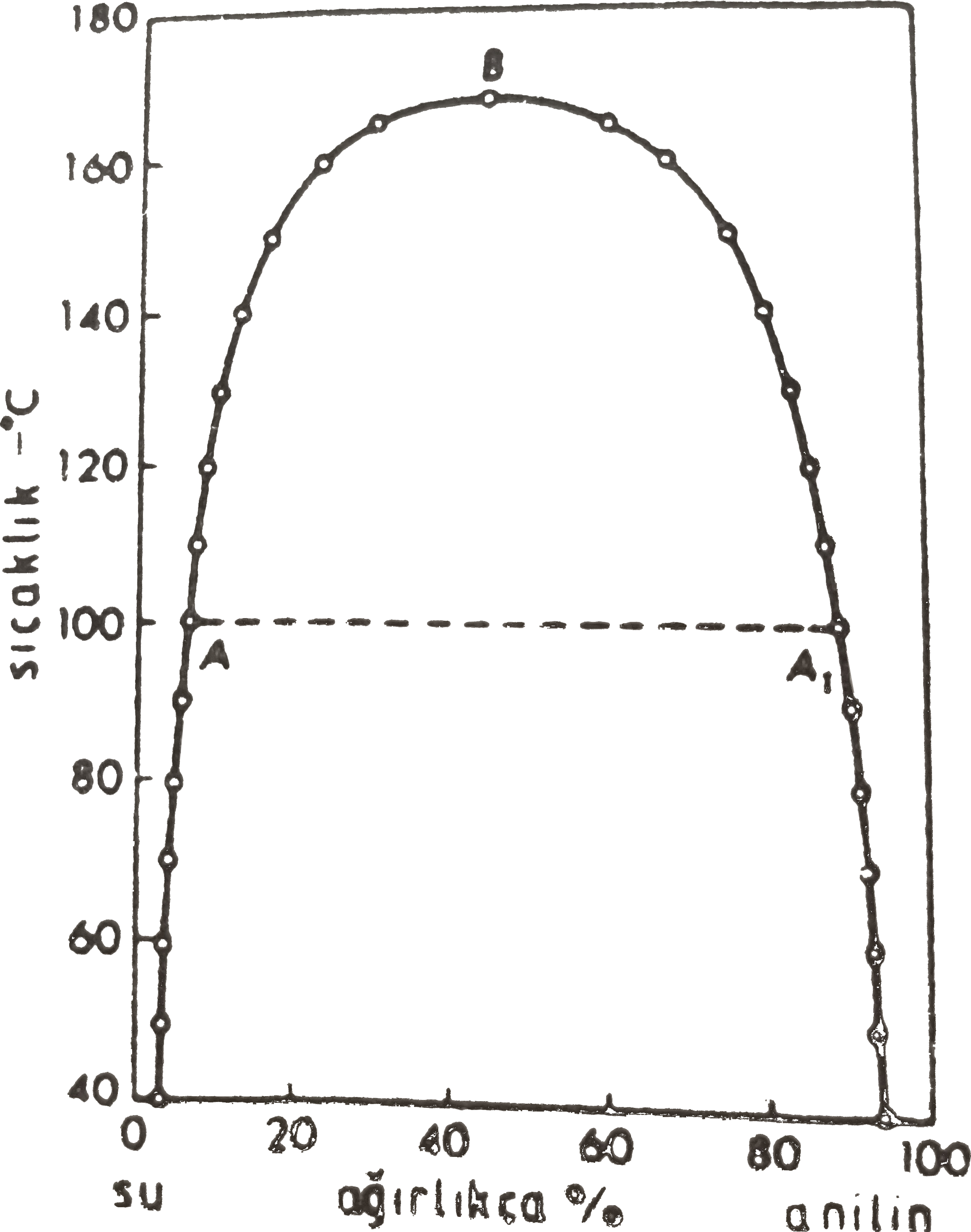
Şekil 2-a da üst kritik çözünme sıcaklığına sahip fenol- su sistemi, Şekil 2-b de ise anilin-su sistemlerinin bileşim-sıcaklık grafikleri görülmektedir.
|
|||||||||||||||||||||
 |
 |
| (a) | (b) |
|
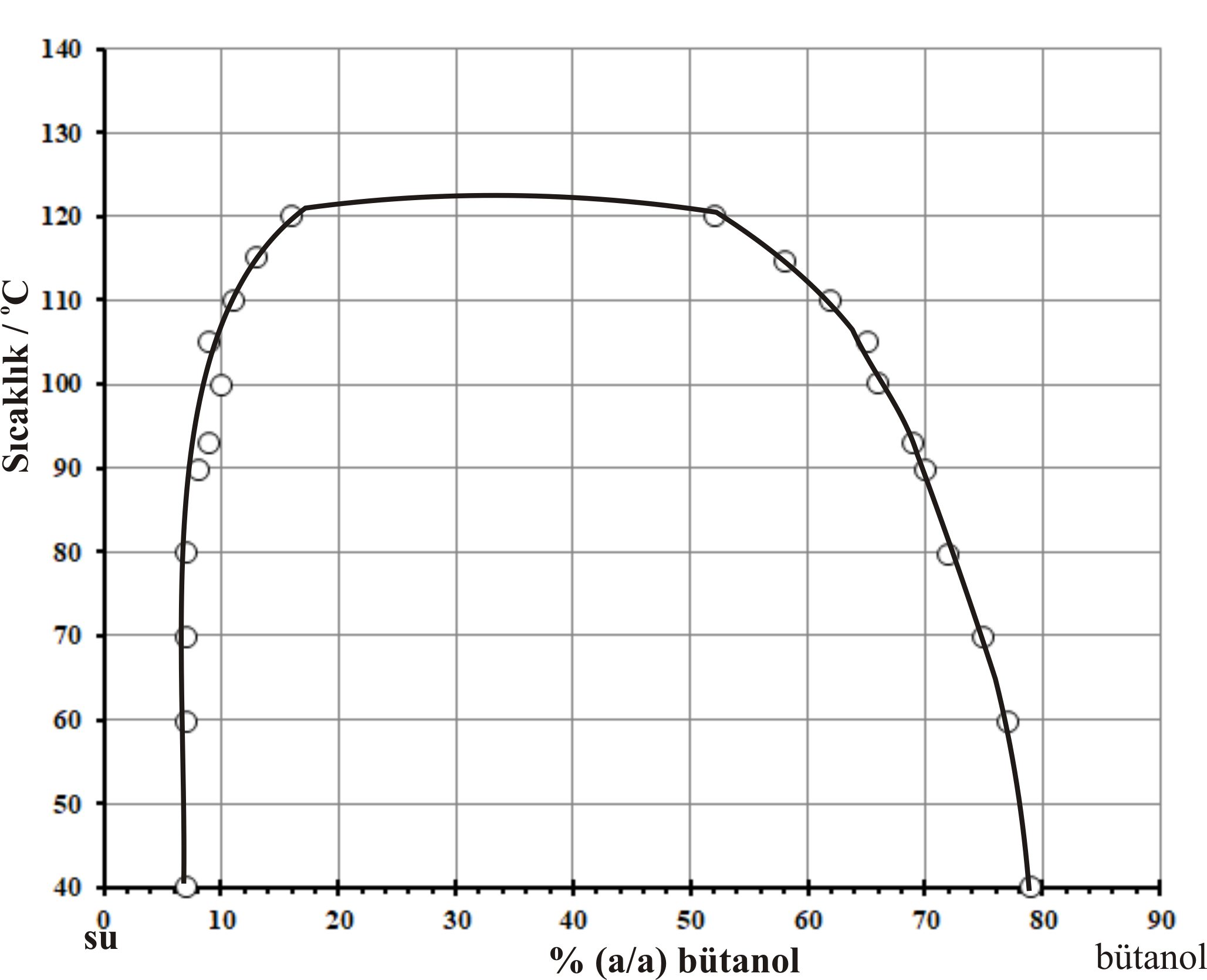
Şekil 3 : (a) trietilamin - su karışımları için bileşim sıcaklık değişim eğrisi. (b) nikotin - su karışımları için bileşim sıcaklık değişim eğrisi |
|
(3). Alt Kritik Çözünme Sıcaklığı (LCST)ve Üst Kritik Çözünme Sıcaklığına (UCST) Sahip Karışımlar
Nikotin - su karışımları bu sistemlere örnek olarak verilebilir. Şekil 3-b de; nikotin - su için, bileşim -sıcaklık grafiği görülmektedir. Nikotin - su sistemi için üst kritik çözünme sıcaklığı 208 \rm ^oC ve alt kritik çözünme sıcaklığı 60.8 \rm ^oC dir. Nikotin - su sistemleri ile yapılan deneylerde dış basıncın arttırılması ile kritik değerlerin birbirine yaklaştıkları görülmüştür.
(3). Kritik Çözünme Sıcaklığına Sahip Olmayan Karışımlar
Bu sınıf altında örnek olarak dietil eter - su karışımları verilebilir. Birbiri içinde kısmen çözünselerde, alt ve üst kritik sıcaklık değerlerine sahip değildir.
Birbiri İle Kısmen Karışabilen Sıvıların Destilasyonu ve Buhar Basınçları
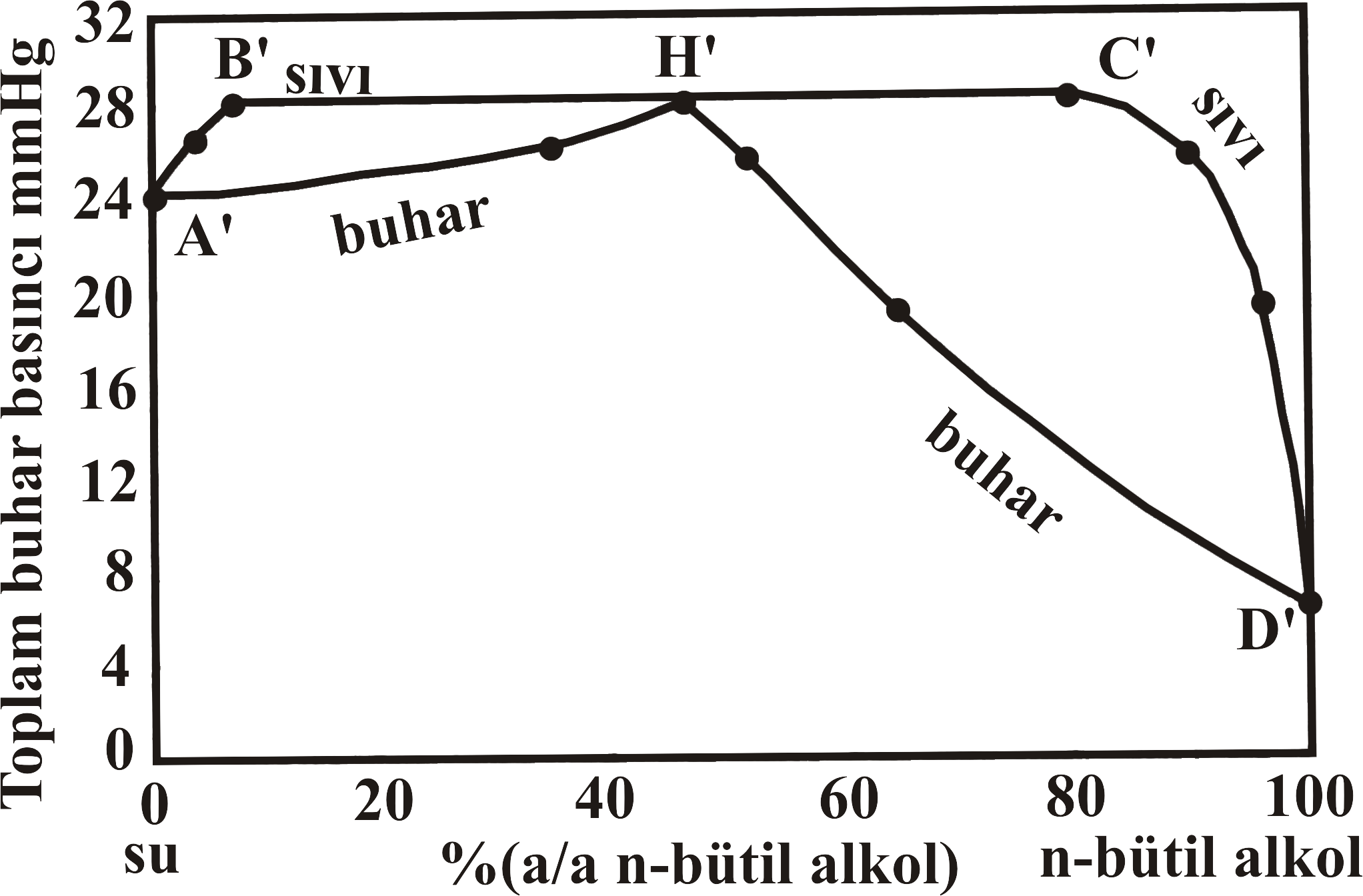
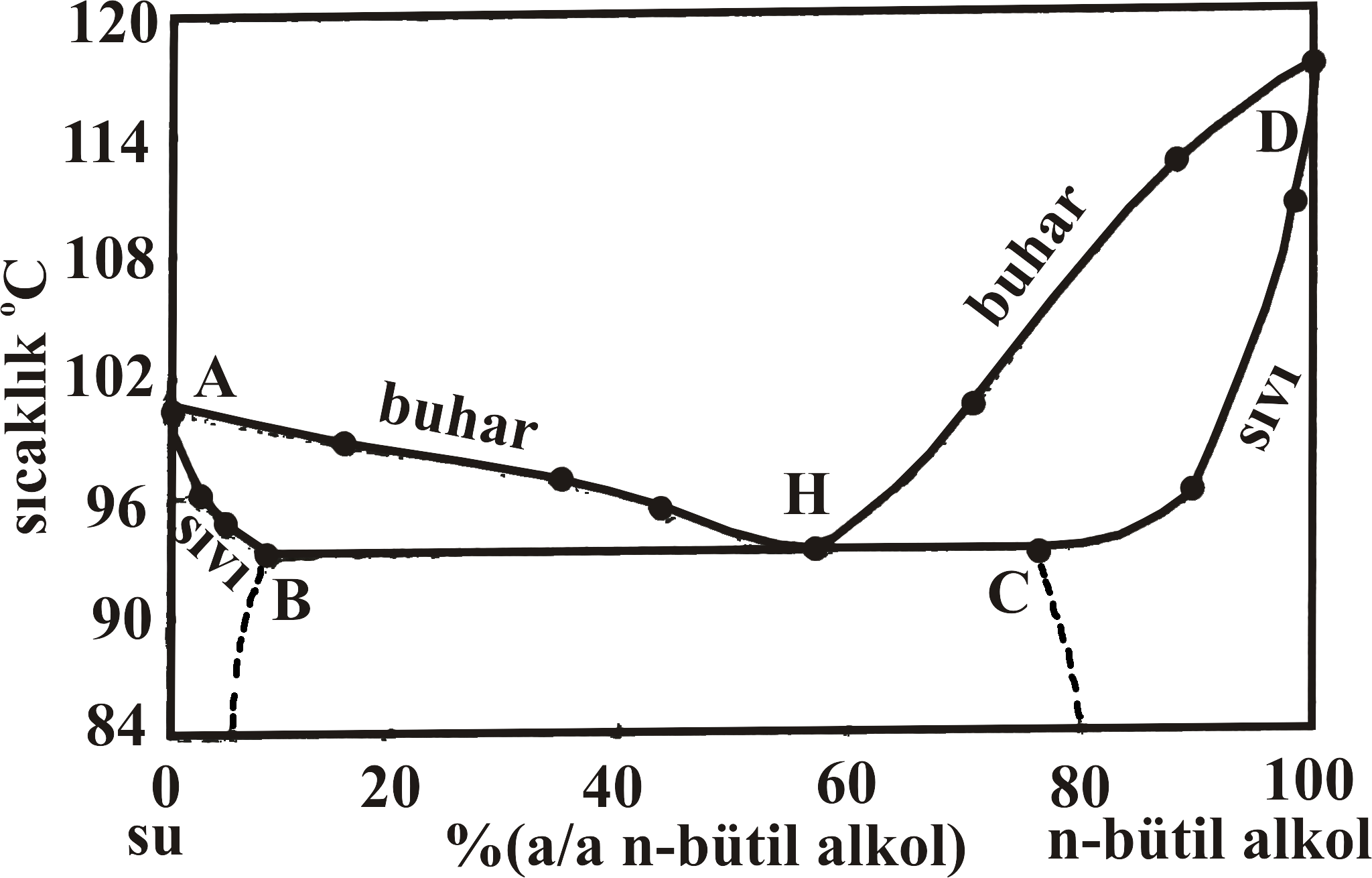
Şekil 4 de biribiri içerisinde kısmen çözünen n-bütil alkol - su karışımı için yüzde bileşime karşın buhar basıncı değişimi, ve sıcaklık değişim grafikleri verilmiştir. Şekil 4-a da D' noktası 25 \rm ^oC saf n-bütil alkolün buhar basıncını gösterirken, Şekil 4-b de D noktası 760 mmHg da saf n-bütil alkolün kaynama noktasını göstermektedir.
Saf n-bütil alkole su eklendikçe buhar basıncı artarak C' noktasına doğru yaklaşırken, kaynama noktası da düşerek C noktasına yaklaşmaktadır. Bu noktadan sonra eklenen su ile buhar basıncı C' noktasından B' noktasına kadar değişim göstermezken, Kaynama noktası da C noktasından B noktasına kadar sabit kalmaktadır.
 |
 |
| (a) | (b) |
 (c) |
|
|
Şekil 4 : (a) n-bütil alkol - su sistemi için 25 \rm ^oC de yüzde bileşim - buhar basıncı değişimi. (b) n-bütil alkol - su sistemi için 760 mmHg de yüzde bileşim - sıcaklık değişimi. (c) n-bütil alkol - su sistemi için yüzde bileşim - sıcaklık faz diyagramı. |
|
B' noktası ve C' noktası arasında buhar basıncı sabit olup H değerine eşittir. Şekil 4-b deki B ve C noktalarındaki kesikli çizgiler iki sıvı bileşenin karşılıklı çözünürlüklerinin sıcaklık ile değişimini göstermektedir.