Birbirine Karışmayan Sıvıların Destilasyonu ve Buhar BasınçlarıBirbirine karışmayan sıvılar, birbiri ile karıştırılmaya çalıştıklarında birbirlerine ilişkin herhangi bir fiziksel veya kimyasal özelliği etkilemezler. Birbiri içinde çözünmedikleriden kısmi buhar basınçları da saf haldeki buhar basınçlarına eşit olacaktır. Bu nedenle; bu tür A ve B bileşeninden oluşan ikili bir karışım için toplam buhar basıncı \rm P_T;
\rm P_T=P_A ^o +P_B ^o \qquad \qquad (I)
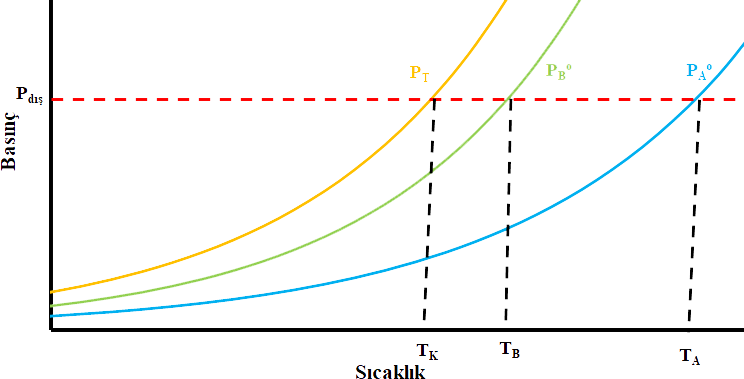
dir. Şekil 1 de A ve B maddelerinin kısmi basınçlarının ve oluşturdukları toplam basıncın sıcaklık ile nasıl değiştiği görülmektedir. Bir maddenin kaynamaya başlaması için buhar basıncının dış basınca eşit olması gereçeği hatırlanacak olursa; A maddesinin \rm T_A sıcaklığında kaynayacağı, B maddesinin ise A maddesinin kaynama sıcaklığından daha düşük olan \rm T_B sıcaklığında kaynayacağı görülür. Bu iki maddeden oluşan sistemin kaynama noktası ise her zaman bu iki maddenin kaynama noktalarıdan daha düşük olan \rm T_K sıcaklığında kaynayacağı kolayca görülebilir. Gaz fazdaki A ve B maddelerinden oluşan karışım dış basıncın \rm P_{dış} olduğu yerde kaynıyorsa \rm P_A ^o = \chi _A P_{dış} \; ve \; P_B ^o= \chi _B P_{dış} olacağından; \rm { P_A ^o \over P_B ^o } = { \chi _A \over \chi _B} \qquad \qquad (II)
olacaktır. Gaz fazdaki maddelerin A ve B maddelerinin mol kesirleri; \rm \chi _A = { n_A\over n_A+n_B} \; ve \; \chi _B = { n_B\over n_A+n_B}
olduğudan; \rm { P_A ^o \over P_B ^o } = { n _A \over n _B} \qquad \qquad (III)
elde edilebilir. Bir i maddesinin mol sayısı, \rm n_i; kütlesi \rm m_i ve mol tartısı \rm M_i, olmak üzere \rm n_i=m_i/M_i olduğundan; \rm { P_A ^o \over P_B ^o } = { m _A \over m _B}. { M_B \over M_A} \qquad \qquad (IV)
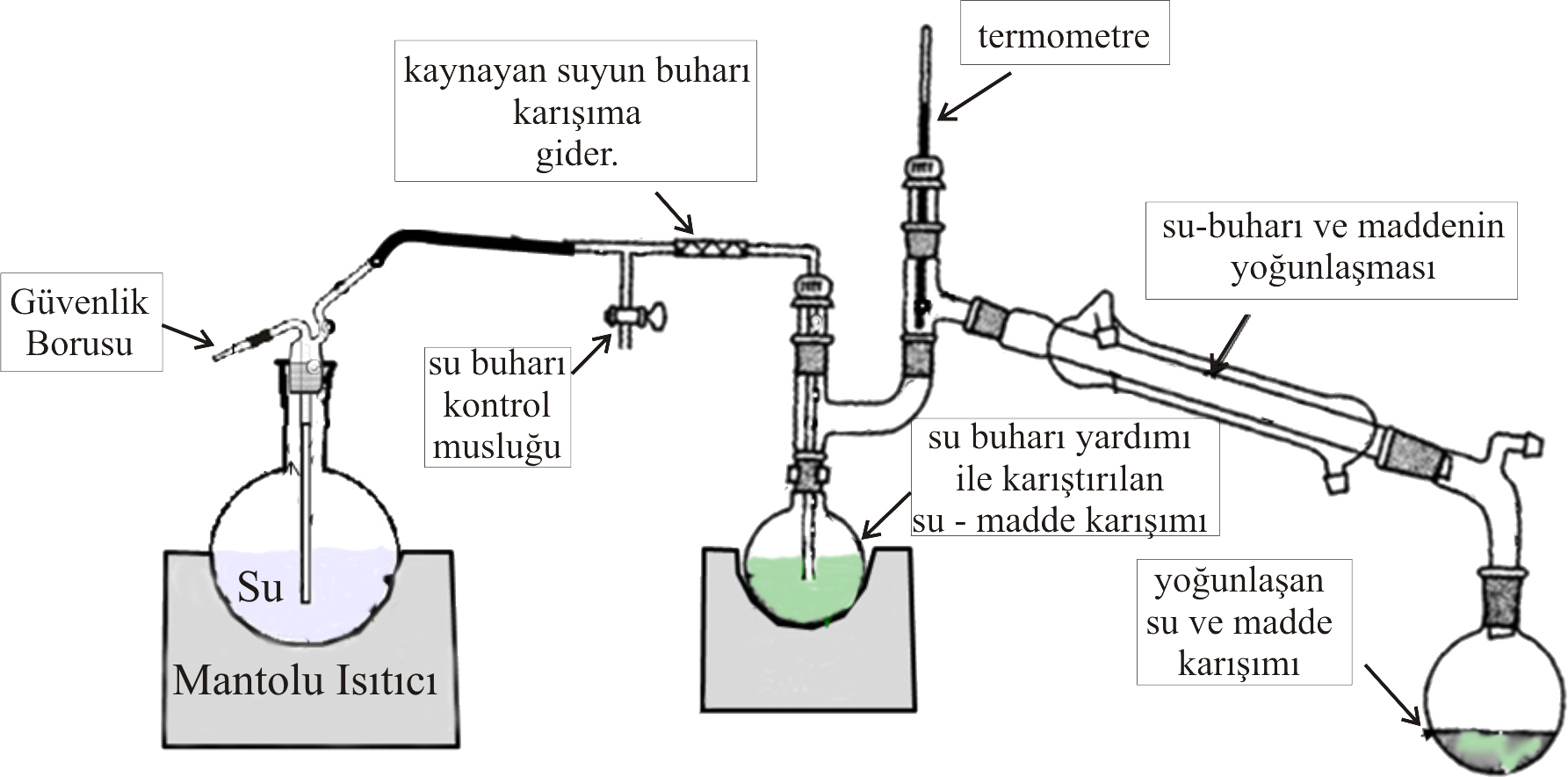
olarak verilebilir. Bazı su ile çözünmeyen maddelerin düşük sıcaklıkta destilasyonu için bu işlemden yararlanılabilir. Şekil 2 deki düzeneğe benzer bir düzenek ile B maddesi kendi kaynama noktası, ve suyun kaynama noktasının altındaki bir sıcaklıkta destillenebilir.
Şekil 2 de kaynatılan suyun buharları su buharı kontrol musluğuna ulaşır. Yeterince su buharı oluşuyorsa musluk kapatılarak B maddesinin bulunduğu balona su buharı gönderilir. Su buharı B maddesini karıştırırken, ayrıca yoğunlaşacağından balon içerisinde su + B maddesi karışımı oluşur. Karışımın sıcaklığı sabit bir değere kadar yükselir ve sabit kalır. Sıcaklık sabit kaldığında su + B maddesi toplama kabında (Şekil 2 de 3. balon ) toplanır. Toplanan karışımın oranlarından hareket ile çeşitli hesaplamalar yapılabilir. Örneğin B maddesinin mol tartısı bulunmak istenirse Çeşitli sıcaklıklarda suyun buhar basıncı \rm P_{su} bilindiğinden ( termometreden okunan sıcaklık dikkate alınarak ), Ayrıca dış basınç \rm P_{dış} biliniyorsa B bileşeninin buhar basıncı \rm P_B ^o=P_{dış}-P_{su} olacağından, Eşitlik IV \rm { P_{su} \over P_{dış}-P_{su} } = { m _{su} \over m _B}. { M_B \over M_{su}}
\rm M_B = \Big( { P_{su} \over P_{dış}-P_{su} } \Big) { M _{su} \over m _{su}}. m_{B} \qquad \qquad (V)
şeklinde düzenlenebilir. Bu eşitlik yardımı ile B maddesinin mol tartısı hesaplanabilir.
|