Gibbs Fazlar KuralıGibbs Phase Rule, Amerikalı bilim adamı J. Willard Gibbs tarafından 1875 yılında keşfedilmiş bir termodinamiğin kuralıdır. Gibbs, termodinamiğin ilk temel kurallarından biri olan Gibbs Fazlar Kuralı'nı keşfettiği sıralarda, fazlar arasındaki ilişkileri açıklamaya yönelik bir kuralı da geliştirdi. Bu kural, daha sonra Gibbs Phase Rule olarak anılmaya başlandı ve termodinamiğin önemli kurallarından biri olarak kabul edildi. Gibbs Phase Rule, günümüzde de hala termodinamiğin önemli kurallarından biri olarak kabul edilmektedir ve birçok alanda yararlı bir araç olarak kullanılmaya devam etmektedir. Kural, bir sistem içinde bulunan fazların sayısını, sistemdeki değiştirilebilir parametrelerin sayısına göre belirler.
Denge halindeki bir sistem için; V; toplam değişkenlerin sayısı, e ; bağımlı değişkenlerin sayısı veya bağlı dengelerin sayısı ve F ; bağımsız değişkenlerin sayısı veya serbestlik derecesi olmak üzere \rm V = e + F
Bir sistemdeki toplam değişkenlerin sayısı; basınç, sıcaklık ve konsantrasyonlar olmalıdır. Bir madde diğer bir madde içerisinde çözündüyse; 1 konsantrasyondan söz ettiğimizde diğer maddenin konsantrasyonu zaten bellidir. Bir madde içinde 2 madde çözündüyse, 3 madde olmasına karşın 2 konsantrasyodan söz etmemiz yeterlidir. Dolayısı ile C bileşenli bir sistem düşünüldüğünde (C-1) konsantrasyondan vardır. P fazlı bir sistemde ise ; P(C-1) konsantrasyon söz konusudur. Bu nedenle; \rm V=2+P(C-1)
dir (Buradaki 2 nin sıcaklık ve basınç olduğunu gözden kaçırmayın.). Bir bileşen P adet faz içerisinde dağılmış olduğunda bağımlı denge sayısı P-1 kadardır. Bu nedenle; \rm e = C(P-1)
dir. \rm F = 2 + P(C-1) + C(P-1)
\rm F = 2 + C-P
eşitliği elde edilebilir. Bu Gibbs Fazlar Kuralının temel ifadesidir.
| 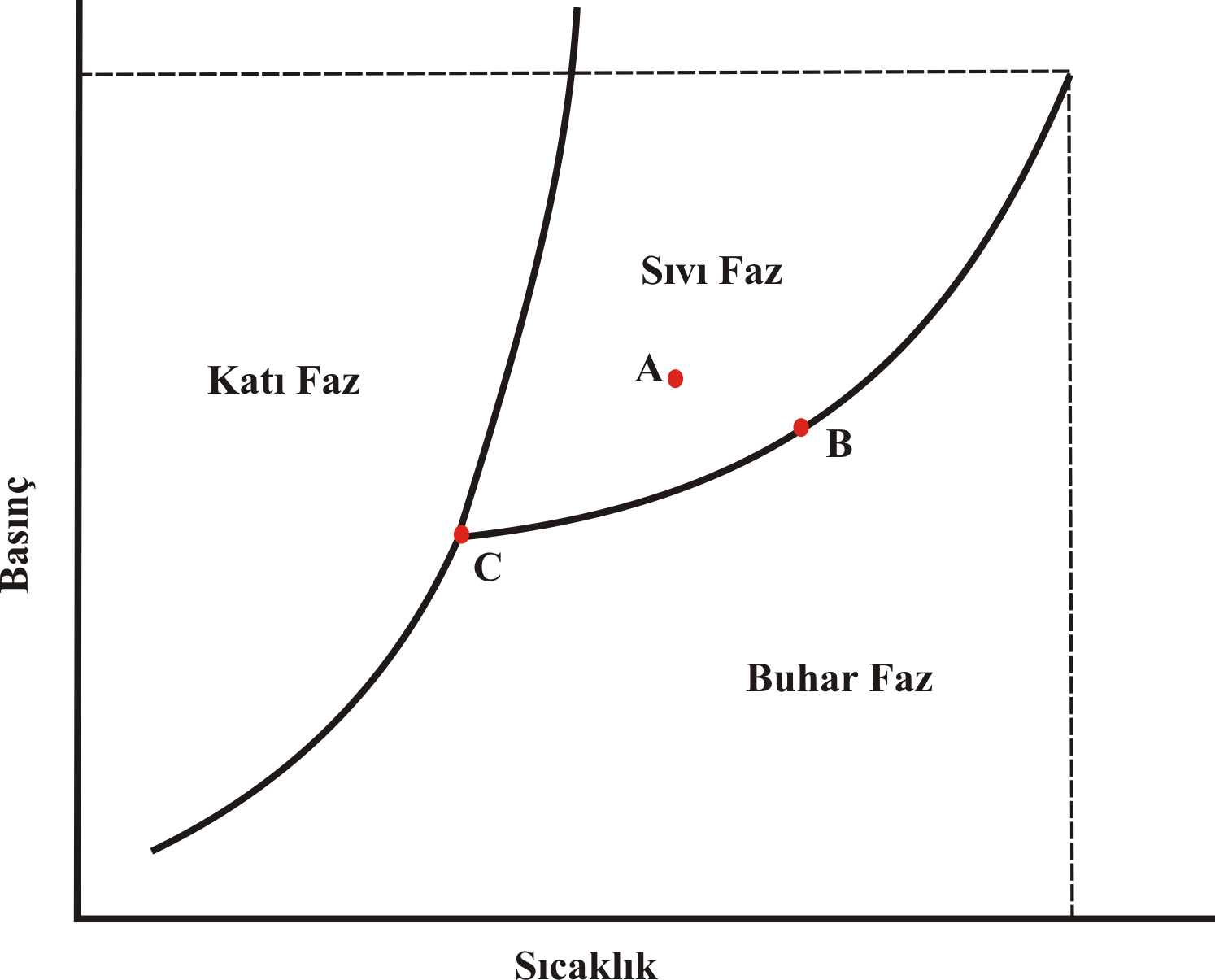
Şekil 1 : Saf bir maddenin faz diyagramı
A Noktası için Gibbs Serbestlik Derecesi ; \rm F = 2 + C-P
\rm F = 2 + 1-1 = 2
F=2 olduğundan sistemin özelliklerini tanımlayabilmek sıcaklık ve basıncın ikisinin de bilinmesine gerek vardır.
B Noktası için Gibbs Serbestlik Derecesi ; \rm F = 2 + C-P
\rm F = 2 + 1-2 = 1
F=1 olduğundan sistemin özelliklerini tanımlayabilmek;
C Noktası için Gibbs Serbestlik Derecesi ; \rm F = 2 + C-P
\rm F = 2 + 1-3 = 0
F=0 olduğundan sistemin özelliklerini bu noktada sıcaklık ve basınç dahil olmak üzere tüm özellikleri bellidir.
|