İdeal Gazların Adyabatik GenleşmesiYalıtılmış veya izole edilmiş bir sistemde ısı kaybı veya kazancı yoksa adyabatik olarak adlandırılır. Adyabatik süreçler pekçok termodinamik kavramı geliştirmek için önemlidir. İdeal bir gazın adyabatik ve tersinir bir süreçte PVT davranışı incelenmeğe değerdir. Elde edilen sonuçlar, izotermal genişlemedeki PVT davranışı ile karşılaştırılırsa iki süreç arasındaki farklılıklar kolayca görülebilir. İzotermal genişlemede T nin sabit ve bu nedenle PV nin sabit olduğu gözden kaçırılmamalıdır. n mol ideal gaz için; \rm { dU \over dT} = nC_v \; veya \; dU = nCvdT
yazabiliriz. Tersinir genleşmenin olduğu bir süreç için ortaya çıkacak işi; \rm W = - PdV = - nRT{ dV \over V}
eşitliği ile daha önce göstermiştik. Adyabatik bir süreç için q = 0 olduğu için, termodinamiğin birinci kanununa göre dU = W veya \rm nC_vdT = -{nRT \over V} dV
\rm nC_v{ dT \over T} = -nR { dV \over V}
yazılabilir. T1 sıcaklığındaki V1 hacmine sahip bir gazın T2 sıcaklığında V2 hacmindeki bir duruma ulaşması sırasında Cv değerinin sabit kaldığını varsayarsak; \rm { C_v \over R } \int_{T_1}^{T_2} { dT \over T } = - \int_{V_1}^{V_2}{ dV \over V }
\rm { C_v \over R } ln{ T_2 \over T_1} = ln { V_2 \over V_1 }
Eşitliği yeniden düzenlersek; \rm V_1T_1^{C_v \over R} = V_2T_2^{C_v \over R} \qquad \qquad \qquad (1)
\rm {V_1 \over V_2} = \big( {T_2 \over T_1 } \big)^{C_v \over R} \qquad \qquad \qquad (2)
eşitliği elde edilebilir. Elde edilen eşitliği daha kullanışlı hale getirmek için T1 ve T2 sıcaklıkları için T=PV/nR ve Cp = Cv + R düzenlemesini yapalım. Böylece; \rm P_1V_1^{C_p \over C_v} = P_2V_2^{C_p \over C_v} = \; K \qquad \qquad \qquad (3)
yazabiliriz. Eşitlik \rm { C_p \over C_v} = \gamma dönüşümü ile \rm P_1V_1^{ \gamma } = P_2V_2^{ \gamma } = \; K \qquad \qquad \qquad (4)
kullanılır. Basınç sıcaklık ilişkisi için gazın ideal davranış gösterdiğinden, V=nRT/T yazılabileceğinden \rm P_1 \Big( { nRT_1 \over P_1 } \Big)^{ \gamma } = P_2 \Big( { nRT_2 \over P_2 } \Big)^{ \gamma } = \; K \qquad \qquad \qquad
\rm P_1^{ 1 - \gamma } T_1^{ \gamma } = P_2^{ 1 - \gamma } T_2^{ \gamma } = \; { K \over (nR)^{ \gamma }} = K' \qquad \qquad \qquad
\rm { T_2 \over T_1} = \Big( { P_2 \over P_1} \Big)^{ ( \gamma - 1 )/ \gamma } \qquad \qquad \qquad ( 5 )
şeklinde elde edilebilir. Adyabatik Süreçte PdV İşi; Adyabatik süreçteki Wadyabatik iş büyülüğü için; \rm W_{adyabatik} = -\int_{V_1}^{V_2} PdV
\rm W_{adyabatik} = -\int_{V_1}^{V_2} KV^{ - \gamma } dV \qquad \qquad \qquad ( \; P = K/ V^{ \gamma } \; olduğundan )
\rm W_{adyabatik} = -K \int_{V_1}^{V_2} V^{ - \gamma } dV
\rm W_{adyabatik} = -K \Big| { V^{ 1 - \gamma } \over 1 - \gamma } \Big|_{V_1}^{V_2}
\rm W_{adyabatik} = - { K \over 1 - \gamma } \big( V_2^{ 1 - \gamma } - V_1^{ 1 - \gamma } \big)
\rm W_{adyabatik} = - { 1 \over 1 - \gamma } \big( KV_2^{ 1 - \gamma } - KV_1^{ 1 - \gamma } \big)
P ile V arasında Eşitlik (4) de \rm K=P_1V_1^{ \gamma }= P_2V_2^{ \gamma }
ilişkisini bildiğimizden; \rm W_{adyabatik} = - { 1 \over 1 - \gamma } \big( P_2V_2^{ \gamma } V_2^{ 1 - \gamma } - P_1V_1^{ \gamma }V_1^{ 1 - \gamma } \big)
\rm W_{adyabatik} = - { 1 \over 1 - \gamma } \big( P_2V_2 - P_1V_1 \big) \qquad \qquad \qquad (6)
ayrıca P1V1 = nRT1 ve P2V2 = nRT2 olduğudan \rm W_{adyabatik} = - { nR \over 1 - \gamma } \big( T_2 - T_1 \big) \qquad \qquad \qquad (7)
yazılabilir.
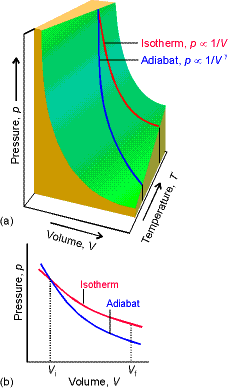
Şekil 1 de tersinir ve adyabatik bir süreçte V ye karşı P nin değişimi gösterilmiştir. Şekil de de kolayca görüldüğü gibi sistem iş yaparken sistemin sıcaklığı düşmektedir. Aynı şekilde gazın izotermal olarak genleşmesi sırasında sıcaklığı değişmez, bunun nedeni çevreden ısı absorbe etmesidir. Tersinir adyabatik bir genleşme için ise gaz kendi termal enerjisini kullanmak zorunda kalır. Sonuç olarak Aynı sıcaklık, basınç ve hacim değerlerinden başlayan adyabatik ve izotermal iki sistemde aynı hacime ulaşmasına karşın, adyabatik sistemdeki basınç ve sıcaklık izotermal sistemdeki basınç ve sıcaklık değerlerinden daha düşüktür. Şekil 1 b de ayrıca izotermal süreçte yapılan işin, izotermal süreç ile yapılan işe göre daha küçük olduğu kolayca görülebilir.
Adyabatik Genleşmede, T, P, dU, dH değişimi örnek soru 1 Adyabatik Genleşmede, T, V, Adyabatik İş ve dH - dU Farkı örnek soru 2
|