Bir molekülün atomizasyon entalpisi diatomik molekül ve tek gaz atomlarının aşağıdaki tabloda verilen
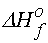 değerlerinden hesaplanır.
değerlerinden hesaplanır.
Kimyasal reaksiyonların enerjilerine ilişkin hesaplamaları moleküler kavrama bağlı olarak açıklayabiliriz.
Örneğin iki atomlu bir gaz parçalanarak iki serbest atoma dönüşebilir. Bu tip bir reaksiyon için
entalpi, bağ entalpisi olarak adlandırılır. Gaz durumdaki diatomik molekülleri içeren
standart haldeki elementlerin atomlarına ilişkin veriler, diatomik moleküllerin dissosiyasyon
spektroskopik verilerinden elde edilir.
Bir molekülün atomizasyon entalpisi diatomik molekül ve tek gaz atomlarının aşağıdaki tabloda verilen 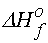 değerlerinden hesaplanır.
değerlerinden hesaplanır.
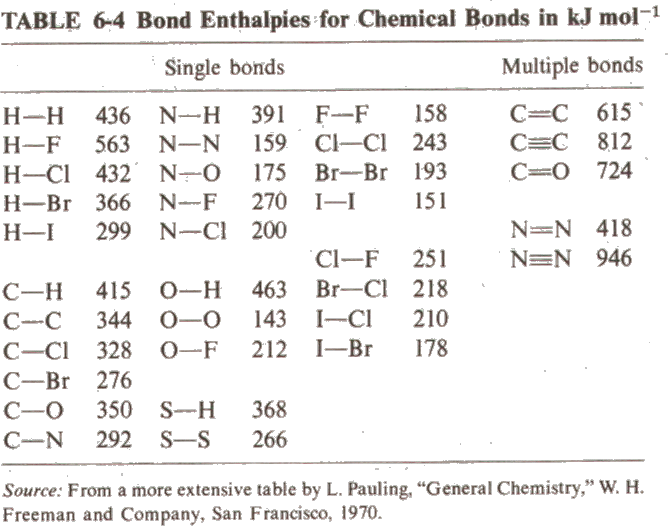
Diatomik türlerin bağ entalpileri atomik türlerin listelenmiş olan entalpilerinden doğrudan hesaplanabilir. Örneğin oksijen için;
O2(g) ------> 2O(g) DHo = 2x(247.52 kJ) = 495.04 kJ
Reaksiyon enerjisi oksijen molekülünün bağ entalpisidir.
Benzer şekilde tek tip bağ içeren poliatomik moleküllerin bağ entalpileri benzer yol ile hesaplanır. Örneğin CH4 için, 25 oC deki verilere göre
CH4(g) -----> C(g) + 4H(g)
DHo, kJ mol-1 ; -74.85 718.38 4x(217.94)
DHo = +1590.14 kJ - (-74.85 kJ) = + 1664.99 kJ
olarak hesaplayabiliriz.
Metanın yapısına bakılırsa yukarıdaki tepkimede 4 adet C-H bağı kırılmıştır. Bu nedenle metandaki C-H bağ entalpisi
(1644.99 kJ/4) = 416.25 kJ
olarak elde edilir. Benzer şekilde diğer bağların bağ entalpileri de belirlenebilir. Örneğin metanol için C-O bağı için bağ enerjisini hesaplamak için, metanolde 3 C-H bağının kırılacağını, 1 C-O bağının ve 1 O-H bağının kırılacağını düşünebiliriz.
CH3OH(g) -----> C + H + O DHo = +2038.91 kJ
DHo =3DHo(C-H) + DHo(C-O) + DHo(O-H)
DHo(C-O) = (+2038.91 kJ) - [3x(416.25 kJ) + (463 kJ)] = 327.16 kJ mol-1
Buradaki 463 kJ değeri O-H için bağ enerjisi olup, metandaki C-H bağ enerjisinin bulunmasına benzer şekilde sudaki H-O bağların enerjilerinden elde edilmiş değerdir. (1)