ÇÖZÜMLER
ÇÖZÜM:
Eğer elektrik motoru saniyede 15 kJ mekanik iş ve 2 kJ çevreye ısı yayıyorsa saniyedeki iç enerji değişimi
DU = - 2 kJ - 15 kJ = -17 kJ
ÇÖZÜM :
(a) Hacim değişmeyeceğinden dV = 0 dır. Bu nedenle iş yapılmaz.
(b) Hacim değişiminin nedeni reaksiyondan kaynaklanacaktır. Demir HCl arasındaki tepkime
Fe(k) + 2HCl(aq) -----> FeCl2(aq) + H2(g)
olduğundan
DV = Vs - Vi 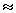 DnRT/Pdış
DnRT/Pdış
W = - PdışDV 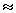 -Pdış(DnRT/Pdış)
-Pdış(DnRT/Pdış)
W 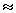 - (50 g / 55.85 g mol-1)x(8.314 J mol-1 K-1)x(298 K) = - 2.2 kJ
- (50 g / 55.85 g mol-1)x(8.314 J mol-1 K-1)x(298 K) = - 2.2 kJ
ÇÖZÜM :
(a) Hacim değişimi;
DV = Vs - Vi = 20 L - 10 L = 10 L
yapılan iş
W = - PdışDV
W = - (2 atm.)x(10 L) = - 20 atm. L.
veya
W = - 20 atm. L.x(8.314 J mol-1 K-1)/(0.082 atm. L mol-1 K-1) = - 2028 J
(b) İzotermal ve tersinir genişleme için öncelikle gazın mol sayısının ne kadar olduğunu bulmamız gerekir.
n = PV/RT
n = (5 atm.)x(10 L)/[(0.082 atm. L mol-1 K-1)x(298 K)] = 2.046 mol
Gazın yapacağı iş;
W = - nRT ln(Vs/Vi)
W = - (2.046 mol)x(8.314 J mol-1 K-1)x(298 K)xln[(20 L)/(10 L)] = -3514 J
ÇÖZÜM :
Elektrik devresinin yaptığı iş miktarı
W = I V t
eşitliğinden hesaplanır.
W = (1 A)(12 V)(3000 s) = 36000 A V s = 36 kJ
Böylece kalorimetrenin ısı kapasitesi;
C = dq/dT
C = (36 kJ)/(5.5 K) = 6.5 kJ K-1
ÇÖZÜM :
Dönüşüm için entalpi değişimi;
DH = Ha - Hk
DH = (Ua + PVa) - (Uk + PVk)
DH = DU + P(Va - Vk)
DH = DU + PDV
1.0 mol 100 g argonit hacmi 37 ve kalsit hacmi 34 cm3 tür. Böylece;
PDV=(1.0x105 Pa)[(34-37)x10-6 m3] = -0.3 J
DH = (0.21 kJ) + (-3x10-4 kJ) = 0.2097 kJ
ÇÖZÜM :
Amonyağın oluşumu için eşitliği;
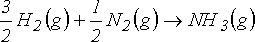
yazarsak, gaz fazındaki mol sayısı değişimini
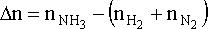
yazabiliriz. Böylece iç enerji değişimi için;
DU = DH - DnRT
DU = - 46.1 kJ - (-1.00 mol)x(8.314x10-3 kJ mol-1 K-1)x(298 K) = - 43.6 kJ
elde edilir.
ÇÖZÜM :
CO2 in entalpisindeki değişme;
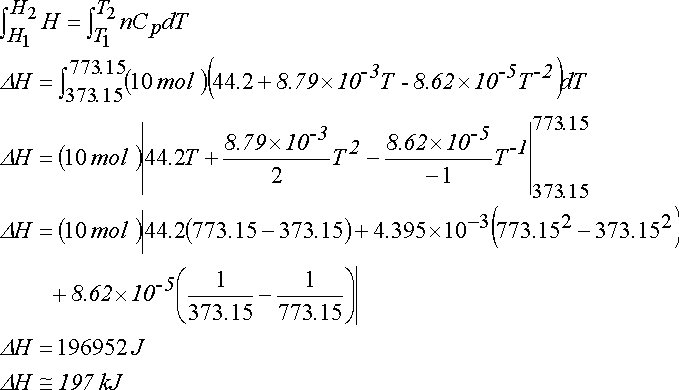
İç Enerjisindeki değişme ise;
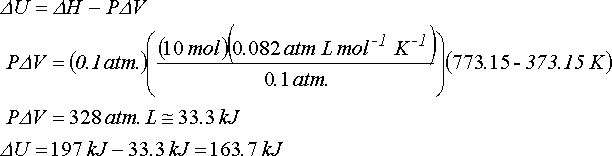
ÇÖZÜM :
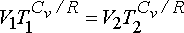 eşitliğinden gazın son sıcaklığını hesaplayabiliriz.
eşitliğinden gazın son sıcaklığını hesaplayabiliriz.
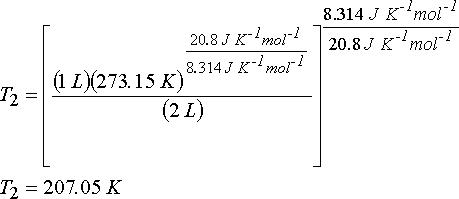
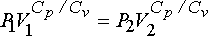 eşitliğinden ise gazın son basıncı hesaplanabilir.
eşitliğinden ise gazın son basıncı hesaplanabilir.
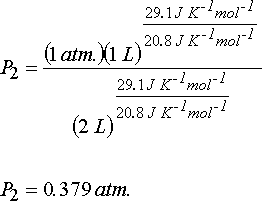
Gazın mol sayısı n; n = PV/RT eşitliğinden;
n = (1 atm.)(1 L)/(0.082 atm. L. mol-1 K-1 )(273.15 K) = 4.46x10-2 mol ve
DU = nCvdT ve DH = nCpdT eşitliklerinden iç enerji değişimi ve entalpi değişimi hesaplanabilir.
DU = (4.46x10-2 mol)(20.8 J mol-1 K-1)(207.05 K - 273.15 K) = - 61.3 J
DH = (4.46x10-2 mol)(29.1 J mol-1 K-1)(207.05 K - 273.15 K) = - 85.8 J
DU = W olduğundan sistem tarafından yapılan iş 61.3 J dür. Sistemin kaybettiği iş yapabilme kapasitesi ise -61.3 J dür.
ÇÖZÜM :
Çözüm için bir önceki sorununun yanıtını inceleyin.
ÇÖZÜM :
CH4 (g) + 2O2 (g) ---> CO2 (g) + 2H2O (g)
Isı kapasitelerinin sıcaklığa bağımlılığı tablosundan
Cp(CH4(g)) = 23.64 + 47.86x10-3T -1.92x10-5T-2 J mol-1 K-1
Cp(O2(g)) = 29.96 + 4.18x10-3T -1.67x10-5T-2 J mol-1 K-1
Cp(CO2(g)) = 44.22 + 8.79x10-3T -8.62x10-5T-2 J mol-1 K-1
Cp(H2O(g)) = 30.54 + 10.29x10-3T J mol-1 K-1
Bileşiklerin Termodinamik verileri ile ilgili tablosundan
DHfo (CH4(g)) = -74.81 kJ mol-1
DHfo (CO2(g)) = -393.509 kJ mol-1
DHfo (H2O(g)) = -241.818 kJ mol-1
DH500 K - DH298 K = 298 K
 500 K
DCpdT
500 K
DCpdT
DH500 K - DH298 K = 298 K
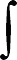 500 K
[[Cp (CO2) + 2Cp (H2O)] - [Cp (CH4O) + 2Cp (O2)]]dT
500 K
[[Cp (CO2) + 2Cp (H2O)] - [Cp (CH4O) + 2Cp (O2)]]dT
DH500 K - DH298 K = 298 K
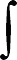 500 K
[
[(44.22 + 8.79x10-3T -8.62x10-5T-2) + 2(30.54 + 10.29x10-3T)]
-
[(23.64 + 47.86x10-3T -1.92x10-5T-2) + 2(29.96 + 4.18x10-3T -1.67x10-5T-2)]
] dT
500 K
[
[(44.22 + 8.79x10-3T -8.62x10-5T-2) + 2(30.54 + 10.29x10-3T)]
-
[(23.64 + 47.86x10-3T -1.92x10-5T-2) + 2(29.96 + 4.18x10-3T -1.67x10-5T-2)]
] dT
DH500 K - DH298 K = 298 K
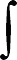 500 K
[
(21.74 - 26.85x10-3T - 3.36-5T)
] dT
500 K
[
(21.74 - 26.85x10-3T - 3.36-5T)
] dT
DH500 K - DH298 K =
21.74 (500 - 298) - 13.425x10-3(5002 - 2982 + 3.36x10-5(1/500 - 1/298) = 2227.4 J
298 K deki reaksiyon entalpisi ise;
DH298 K =
[
DHfo (CO2)
+
2DHfo (H2O)
]
-
[
DHfo (CH4)
+
2DHfo (O2)
]
DH298 K =
[
(-393.509 kJ mol-1)
+
2(-241.818 kJ mol-1)
]
-
[
(-74.81 kJ mol-1)
+
2(0 kJ mol-1)
] = -802.335 kJ
Böylece 500 K deki reaksiyon entalpisi
DH500 K = 2.2 kJ - 802.335 kJ = 800.135 kJ
olarak hesaplanabilir.
ÇÖZÜM :
Bağ Enerjileri, ve standart oluşum enerjileri tablolardan;
DH(C-H) = 415 kJ mol-1
DH(C-C) = 344 kJ mol-1
DH(C=C) = 615 kJ mol-1
DH(H-H) = 436 kJ mol-1
DHfo(C3H8) = -104.5 kJ mol-1
DH(C3H6) = 20.2 kJ mol-1
olarak bulunabilir.
Bağ enerjilerine göre hidrojenasyon ısısı;
C3H6(g) + H2 ---> C3H8(g)
DH298 = 8DH298(C-H) - [6DH298(C-H) + DH298(C-C) + DH298(C=C)+ DH298(H-H)]
DH298 = [8(-415 kJ mol-1) + 2(-344 kJ mol-1)) - [6(-415 kJ mol-1) + (-344 kJ mol-1) + (-615 kJ mol-1) + (-436 kJ mol-1)]
DH298 = -123 kJ mol-1
olarak hesaplanabilir.
Maddenin standart oluşum enerjilerinden hidrojenasyon ısısı
DH298 = [DH298(C3H8)] -
[DH298(C3H6) + DH298(H2)]
DH298 = [(-104.5 kJ mol-1)] - [(20.2 kJ mol-1) + (0 kJ mol-1)]
DH298 = -124.6 kJ mol-1
Bu aradaki fark bağ enerjilerinin elde edildiği moleküllerdeki bağ enerjisi farklılığından kaynaklanır.
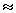 DnRT/Pdış
DnRT/Pdış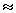 -Pdış(DnRT/Pdış)
-Pdış(DnRT/Pdış)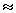 - (50 g / 55.85 g mol-1)x(8.314 J mol-1 K-1)x(298 K) = - 2.2 kJ
- (50 g / 55.85 g mol-1)x(8.314 J mol-1 K-1)x(298 K) = - 2.2 kJ
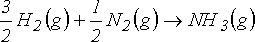
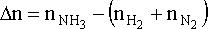
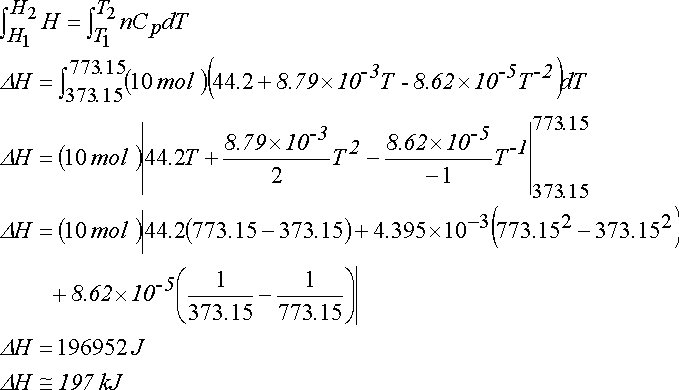
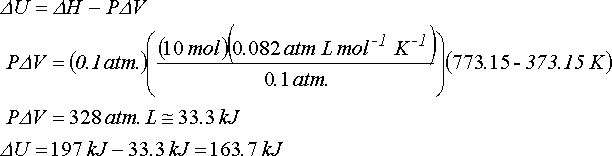
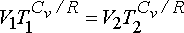 eşitliğinden gazın son sıcaklığını hesaplayabiliriz.
eşitliğinden gazın son sıcaklığını hesaplayabiliriz. 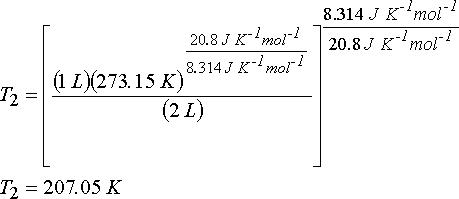
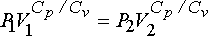 eşitliğinden ise gazın son basıncı hesaplanabilir.
eşitliğinden ise gazın son basıncı hesaplanabilir.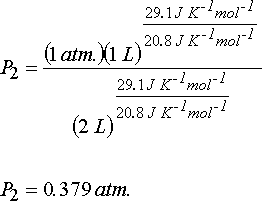
 500 K
DCpdT
500 K
DCpdT