ENTALPİ
Şimdi bir cismin iç enerji değişimini hesaplayabilmek için ona q kadarlık ısı verdiğimizi
(örneğin bir elektrik devresindeki bir direncin birim zamanda ne kadar ısı verdiğini biliriz.)
veya bir reaksiyon sonucu q kadarlık ısı açığa çıktığını (çıkan ısı yardımıyla bir cismin
örneğin suyun sıcaklık değişimininden yararlanabiliriz.) varsayalım. Isı verdiğimiz sistemin
sıcaklığının dT kadarlık bir değişim gerçekleşirken, bu değişimi gerçekleştiren ısı miktarının
dq kadar olduğunu görürüz. dT ile dq arasında doğrusal bir ilişki olduğundan;
dq = CdT
yazabiliriz. Buradaki C ısı kapasitesi olarak adlandırılır ayrıca buradaki ısı q sabit
hacimde meydana geldiğinden qv olarak da adlandırılır. (Örnek 1)
İç enerji değişimi için bu nedenle;

yazabiliriz. Buradaki Cv işlemin sabit hacimde yapıldığını ve herhangi bir iş katkısının bulunmadığını gösterir.
Eğer sistemdeki olaylar sabit bir dış basınca karşı gerçekleşirse bir başka
söyleyişle, sistemin hacmi değişiyorsa dıştan verilen ısının bir kısmı ise bir iş yapılmasında
kullanılacaktır. Bu nedenle böyle bir sistemde verilen ısı miktarı ile içi enerji arasında
dU < dq ilişkisi söz konusu olacaktır. Bu gibi durumlar için; sabit bir dış basınca karşı
harcanan ısı ile ilişkili olan bir başka termodinamik özellik olarak adlandıracağımız entalpi
değerinden söz edeceğiz. Entalpi, H, için;
H = U + PV
Olarak ifade edilebilir. Buradaki P sistemin basıncıdır ve PV herhangi bir sistem için
entalpiyi belirleyen bir kısımdırdır. Herhangi bir hal fonksiyonu olarak herhangi bir başlangıç
ve son hal arasındaki entalpi değişimi izlenen yoldan bağımsızdır.
Şimdi dH büyüklüğünün; herhangi bir ilave iş olmaksızın bir sistemin sabit
basınçtaki ısı değişimine eşit olduğunu göstermeye çalışalım. Böyle bir durum için;
dH = dU + d(PV)
dU = dqv + dWgenleşme - PdışdV
olduğundan;
dH = dqv + dWgenleşme - PdışdV + PdV + VdP
ısı değişimi sabit basınçta (dP = 0) meydana geldiğinden;
dH = dqv + PdV = dqp
eğer gaz ideal ise; bir reaksiyondaki entalpi değişimi için;
DH = DU + Dn RT
yazabiliriz. Bu kez verilen ısı sistemin sıcaklığını artırmak yanında bir iş yapılması içinde
kullanılmıştır. Buradaki qp ısının sabit bir basınçta verildiğini gösterir. Örneğin bir açık
bir kap içerisindeki suya elektrikli bir ısıtıcı daldırılmış ve 36 Kj luk bir enerji verilmişse,
suyun entalpisi 36 KJ artmıştır (DH = +36 KJ) diyebiliriz.
Yukarıda iç enerjinin hesaplanması için verilen ısı ve sistemin sıcaklık artışından
yararlanarak nasıl bir hesaplama yapabilceğimizden bahsetmiştik. Şimdi benzer bir yol kullanarak
entalpi değişiminin nasıl hesaplanabilceği üzerinde durmaya çalışalım. Yukarıda iç enerji
değimimini hesaplarken herhangi bir iş katkısı olmaksızın verilen ısı q nun sıcaklık T yi
değişimini göz önünde bulundurmuştuk. Oysa şimdi ısıyı verirken sistemin üzerindeki basıncın
sabit olması gerektiğini düşünmeliz. Başka bir deyişle olay verilen ısı iş yapılmasında da
kullanılacaktır. Bu nedenle her ik değerin DU ve DH
değerleri birbirlerinden farklı olacaklardır. sabit basınç veya sabit hacimdeki
hesaplamaların herbiri için farklı bir spesifik ısı olması zorunluluğunu getirir.
Örneğin; sabit basınçta sistemdeki ısı farkı dq bir ısı farklılığı
meydana gelirken, sıcaklık artışı DT kadar değişmişse sistemin spesifik ısısı için;
Cp = dq /dT
yazılabilir. Buradaki Cp; sabit basınçtaki spesifik ısıdır. Buradan;
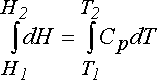
yazılır.(Örnek 1, 2, 3)
E l e k t r o n i k K a y n a k l a r
Joule's Law
Joule's Mechanical Equivalent of Heat Apparatus
Joule's Equivalent
James Prescott Joule (1818 - 1889)