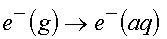İyonların Çözünme Enerjileri
Burada gaz haldeki iyonların suda çözünmesi ile ortaya çıkacak sulu çözeltideki oluşum ısıları için elde edilmiş değerler üzerinde durulacaktır. Elektrolitlerin çözünme ısıları için kalorimetrik olarak elde edilmiş çözünme ısılarından iyonların çözünme ısıları aşağıdaki tabloda toplanmıştır.
25 oC deki suda; kristal metal halojenürlerin ve gaz hidrojen halojenürlerin çözünmeleri için kJ mol-1 olarak DH değerleri
|
F- |
Cl- |
Br- |
I- |
H+ |
-48.5 |
-72.8 |
-83.5 |
-80.4 |
Li+ |
+4.2 |
-35.1 |
-47.1 |
-61.7 |
Na+ |
+2.5 |
+4.3 |
+0.4 |
-5.2 |
K+ |
-15.1 |
+17.2 |
+19.8 |
+21.8 |
Rb+ |
-24.3 |
+18.4 |
+24.9 |
+27.2 |
Cs+ |
-36.0 |
+20.0 |
+28.2 |
34.5 |
Ag+ |
-14.2 |
+66.1 |
+84.0 |
+111.8 |
Tl+ |
--- |
+42.3 |
+54.4 |
+73.3 |
Mg2+ |
-11.6 |
-150.3 |
-181.2 |
-208.4 |
Zn2+ |
--- |
-65.4 |
-62.8 |
-47.3 |
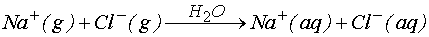
şeklindeki bir reaksiyonu ele alırsak, çözünme süreci için entalpi değerinin nasıl hesaplanacağını yukarıdaki verileri kullanarak belirlemeye çalışalım. Yukarıdaki tablodan;
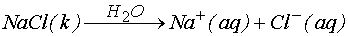 DH = 4.3 kJ
DH = 4.3 kJ
yazabiliriz. Kristal NaCl ün gaz fazda iyonlaşarak Na+(g) ve Cl-(g) vermesi için entalpi değişimi olan kristallenme enerjisine ihtiyaç vardır.
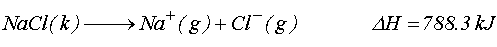
Bu son iki eşitlikten yararlanarak
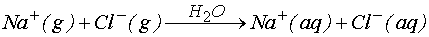 DH = -784 kJ
DH = -784 kJ
Hidrojen halojenürler için benzer hesaplamaları yapmak istersek, örgü enerjileri yerine aşağıdaki reaksiyon entalpisine ihtiyaç vardır.
HX(g) -----> H+(g) + X-(g)
Bu değer, dissosiyasyon enerjileri, iyonlaşma potansiyelleri, ve elektron ilgileri kullanılarak hesaplanabilir. HCl için açıklayacak olursak
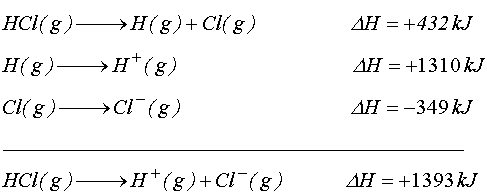
yazabiliriz. Bu son değeri HCl(g) suda çözünmesiyle ortaya çıkan -72.8 kJ mol-1 değeri ile birleştirirsek;
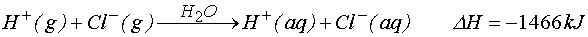
yazarız.
Bu şekilde elektrolitlerin gaz iyonların çözeltileri için ortaya çıkan entalpi değerleri aşağıdaki tabloda verilmiştir.
25 oC deki suda; kristal metal halojenürlerin ve gaz hidrojen halojenürlerin iyonlarının çözünmeleri için kJ mol-1 olarak DH değerleri.
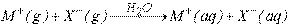 tipi süreçler için:
tipi süreçler için:
|
F- |
Cl- |
Br- |
I- |
H+ |
-1599 |
-1466 |
-1435 |
-1384 |
Li+ |
-1047 |
-897 |
--- |
--- |
Na+ |
-929 |
-784 |
-752 |
-710 |
K+ |
-844 |
-700 |
-668 |
-627 |
Bu yaklaşım bize kolaylık sağlamasına karşın protonun hidratasyon entalpisinin sıfır olması düşündürücüdür. Çünkü proton ve su moleküllerinin etkileşimlerine ilişkin olarak entalpi değişiminin sıfır olduğunu söylemek zordur. Kütle spektroskopisi ile yapılan hesaplamalar protonun su moleküllerinin oluşturduğu bir yapı içinde bulunduğunu gösterir. Yapılan hesaplamalara göre

Olmalıdır. Bu değer kullanılarak diğer iyonların hidratasyon entalpileri hesaplanabilir. Bir elektronun yakalanmasına ilişkin değer -170 kJ mol-1 civarındadır.
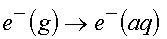
E l e k t r o n i k K a y n a k l a r
Joule's Law
Joule's Mechanical Equivalent of Heat Apparatus
Joule's Equivalent
James Prescott Joule (1818 - 1889)
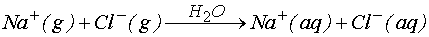
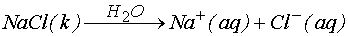 DH = 4.3 kJ
DH = 4.3 kJ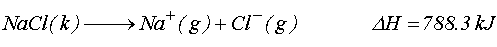
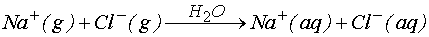 DH = -784 kJ
DH = -784 kJ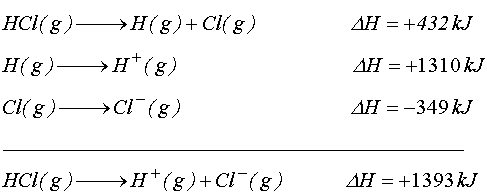
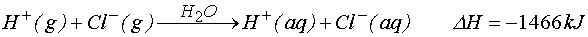
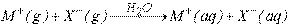 tipi süreçler için:
tipi süreçler için: