Reaktifler ----- > Ürünler
şeklinde gösterilebilir.
Süreçler için iç enerji ve entalpi değişimi, reaktif ve ürünlerin enerji ve entalpi içerikleri ile ilişkilidir ve
DU = UÜrünler - UReaktifler
ve
DH = HÜrünler - HReaktifler
ifadelerinden hesaplanabilir. Örneğin;
C + 1/2 O2 ----- > CO
reaksiyonu için, 1 mol karbonmonoksitin entalpisi, 1 mol karbon ve 1 mol oksijenin yarım molünün entalpisinin toplamı ile karşılaştırılarak hesaplanır.
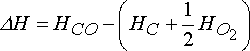
Eğer ürünler reaktiflerden daha fazla enerji içeriyorsa reaksiyonda ısı absorbe edilir. Bu durumda DU (süreç sabit hacimde gerçekleşiyorsa) ve DH (süreç sabit basınçta gerçekleşiyorsa) pozitif olur. Reaksiyon sonucu İç enerji ve entalpi artar. Bu tip reaksiyonlar endotermik olarak adlandırılır. Reaksiyonlarda DU ve DH negatif ise süreç sırasında iç enerji ve entalpi azalır. Bu nedenle dışarı ısı verilir. ve reaksiyon ekzotermik olarak adlandırılır. Tüm yanma tepkimeleri ekzotermiktir. Bu nedenle bu reaksiyonlarda DU ve DH negatiftir.