Gerçek Gazların Serbest Enerjilerinin Basınca Bağımlığı : Fugasite
İdeal gaz sistemlerindeki sınırları kaldırarak gerçek gazlar için serbest enerji değişiminin basınca bağımlılığını ortaya çıkartmaya çalışacağız. Bu amaçla iki eşitlikle öncekle başlamamız gerekecek,
(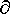 G/
G/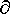 P)T = V ve G = Go + RTlnP
P)T = V ve G = Go + RTlnP
(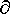 G/
G/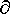 P)T eşitliğinin integrasyonu gerçek gazları için van der Waals eşitliği kullanılarak hesaplanabilir. Bununla beraber DG eşitliği için sonuç kompleks ve dar bir basınç aralığı için geçerlidir.
P)T eşitliğinin integrasyonu gerçek gazları için van der Waals eşitliği kullanılarak hesaplanabilir. Bununla beraber DG eşitliği için sonuç kompleks ve dar bir basınç aralığı için geçerlidir.
 Daha önce ideal gazlar için yazdığımız serbest enerji - basınç eşitlikleri için benzer şekilde hesaplamalar yapılabilir.
Daha önce ideal gazlar için yazdığımız serbest enerji - basınç eşitlikleri için benzer şekilde hesaplamalar yapılabilir.
Daha doyurucu bir süreç ise fugasite, f olarak adlandırılan
yeni bir fonksiyon kullanılarak gerçekleştirilebilir. P1 ve P2 basıncındaki gazın serbest enerjileri G1 ve G2 ise, bu basınçlardaki gazın fugasitesi f1 ve f2 olarak gösterilmek üzere, serbest enerji değişimi için;
G2 - G1 = RT ln(f2/f1)
yazılır. Bu eşitlik fugasite terimleri arkasında gerçek gazlara ilişkin olan kompleksliği gizler. Elde edilmiş olan bu eşitliği
G2 - G1 = RT ln(P2/P1) eşitliği ile karşılaştıracak olursak fugasitelerin basınçlarla orantılı olduğunu görebiliriz. Gerçek bir gaz ne kadar fazla ideal gaz davranışından sapma gösteriyorsa, fugasiteside aynı ölçüde değişir.
Sabit sıcaklıktaki bir mol gaz için termodinamik eşitliği
G2 - G1 =  VdP
VdP
olarak yazabiliriz. Bu integrale RT/P eklenip çıkartılabilir. Böylece ;
G2 - G1 = 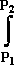 [(RT/P) + (V - RT/P)]dP
[(RT/P) + (V - RT/P)]dP
= 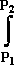 (RT/P)dP +
(RT/P)dP + 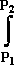 (V - RT/P)dP
(V - RT/P)dP
= RT ln (P2/P1) + 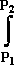 (V - RT/P)dP
(V - RT/P)dP
eşitliği elde edilebilir. Bu eşitlik fugasiteye bağlı serbest enerji eşitliği ile karşılaştırılacak olursa;
RT ln (f2/f1) = RT ln (P2/P1) + 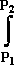 (V - RT/P)dP
(V - RT/P)dP
veya
RT ln [(f2/P2)/(f1/P1)] = 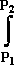 (V - RT/P)dP
(V - RT/P)dP
yazılabilir. Tüm gazlar sıfır atmosfer basınca yaklaşırken ideal davranış gösterirler.
P 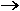 0 yaklaşırken, (f/P)
0 yaklaşırken, (f/P) 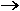 1 yaklaşır.
1 yaklaşır.
 Çeşitli sıcaklık ve basınçlardaki fugasite büyüklükleri karşılıklı haller ilkesine göre hesaplanabilir. Bu hesaplamayı yapabilmek için indirgenmiş değişkenler olan PR, VR, TR değerlerine ihtiyaç vardır.
İndirgenmiş basınç ile sıkıştırılabilirlik faktörü Z nin değişimi, çeşitli TR değerleri için yandaki şekilde gösterilmiştir. Bu veriler yukarıdaki eşitliğin integrasyonu için gereklidir. Sıkıştırılabilirlik faktörü Z;
Çeşitli sıcaklık ve basınçlardaki fugasite büyüklükleri karşılıklı haller ilkesine göre hesaplanabilir. Bu hesaplamayı yapabilmek için indirgenmiş değişkenler olan PR, VR, TR değerlerine ihtiyaç vardır.
İndirgenmiş basınç ile sıkıştırılabilirlik faktörü Z nin değişimi, çeşitli TR değerleri için yandaki şekilde gösterilmiştir. Bu veriler yukarıdaki eşitliğin integrasyonu için gereklidir. Sıkıştırılabilirlik faktörü Z;
Z = PV/RT
veya
V = (RT/P)Z
 RT ln (f/P) =
RT ln (f/P) = 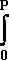 (ZRT/P - RT/P)dP = RT
(ZRT/P - RT/P)dP = RT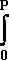 (Z - 1)dP/P
(Z - 1)dP/P
veya
ln (f/P) = 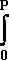 (Z - 1)dP/P =
(Z - 1)dP/P = 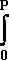 (Z - 1)dPR/PR
(Z - 1)dPR/PR
Çeşitli TR değerleri için PR nin bir fonksiyonu olarak Z verileri yandaki grafikte gösterilmiştir.
Gerçek Gazlar İçin Standart Hal :
Aktivite ve aktiflik Katsayıları
İdeal gazlar için gazın 1 atm. basınçtaki standart-hal molar serbest enerjisi Go olarak seçilmiştir. Gazın serbest enerji değişiminin
G = Go + RT ln Patm.
eşitliği ile verilebileceğini daha önce göstermiştik.
Gerçek gazlar için standart hali seçmek için bir yönteme ve
değişen şartlarla birlikte serbest enerji değişimini
hesaplamamıza yardım edecek bir eşitliğe ihtiyacımız olacak.
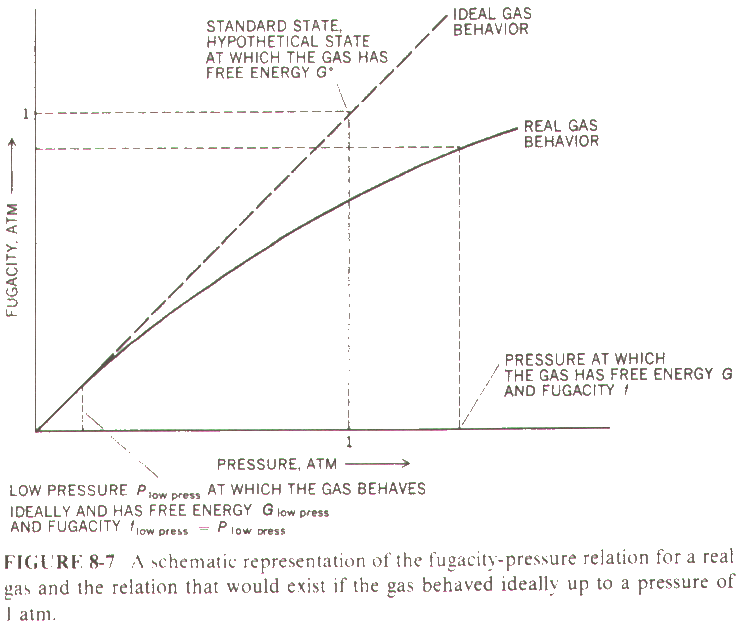
Gerçek gazlar için,
seçilmesi gereken standart hal fugasitesi 1 atm. eşit olduğu yer olmalıdır.
Bu da gazın sıfır basıncın üzerindeki bir yerde fugasitesinin ideal davranış gösterdiği yer olarak kabul edilebilir.
Gerçek gazların standart hali için varsayımsal olarak seçilmiş bu nokta yandaki şekilde gösterilmektedir.
İdeal davranış göstermeyen bir gazın serbest enerjisi çeşitli P basınçlarında yandaki şekilde gösterildiği gibi belirlenmiş olsun.
Eğer P basıncındaki bir fugasite değeri söz konusuysa, bu basınçtaki serbest enerji, G, düşük basınçlardaki ,Pdüşük basınç, serbest enerji Gdüşük basınç ile
G - Gdüşük basınç = RT ln (f/fdüşük basınç) = RT ln (f/Pdüşük basınç)
şeklinde ilişkilidir.
Serbest enerji Gdüşük basınç ve ideal davranıştaki standart hal serbest enerji arasındaki ilişki
Go - Gdüşük basınç = RT ln(1 atm/Pdüşük basınç)
olduğundan;
Son iki eşitlik birbirinden çıkartılarak
G - Go = RT ln (fP/ 1 atm.) veya
G - Go = RT ln fP
yazılabilir.
Gerçi herhangi bir basınçtaki gazın serbest enerjisi, varsayımsal olan Go bu standart serbest enerji ile ilişkili gözükmektedir. Bu eşitlik ideal gaz eşitliği ile karşılaştırılırsa,
f ile P nin ilişkili olduğu görülür. Bu bir katsayı olan aktiflik katsayısı, g ile gösterilebilir.
g = f/P
Gerçek gazlar için serbest enerji eşitliğine bu faktör dahil edilerek
G - Go = RT ln gP
olarak yazılabilir. Bu faktör gazların ideallikten sapmasının ölçüsünü gösterir.
E l e k t r o n i k K a y n a k l a r
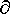 G/
G/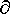 P)T = V ve G = Go + RTlnP
P)T = V ve G = Go + RTlnP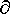 G/
G/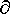 P)T eşitliğinin integrasyonu gerçek gazları için van der Waals eşitliği kullanılarak hesaplanabilir. Bununla beraber DG eşitliği için sonuç kompleks ve dar bir basınç aralığı için geçerlidir.
P)T eşitliğinin integrasyonu gerçek gazları için van der Waals eşitliği kullanılarak hesaplanabilir. Bununla beraber DG eşitliği için sonuç kompleks ve dar bir basınç aralığı için geçerlidir.
 Daha önce ideal gazlar için yazdığımız serbest enerji - basınç eşitlikleri için benzer şekilde hesaplamalar yapılabilir.
Daha önce ideal gazlar için yazdığımız serbest enerji - basınç eşitlikleri için benzer şekilde hesaplamalar yapılabilir.
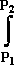 VdP
VdP
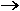 0 yaklaşırken, (f/P)
0 yaklaşırken, (f/P) 

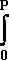 (ZRT/P - RT/P)dP = RT
(ZRT/P - RT/P)dP = RT