HCl(g) -----> H+(aq) + Cl-(aq)
Buradaki (aq) sembolü iyonun büyük miktarda suda bulunduğunu gösterir. 25 oC de ortaya çıkan ısı 75.14 kJ dür. Böylece reaksiyon entalpi için
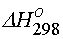 = 75.14 kJ =
= 75.14 kJ = 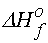 [H+(aq) + Cl-(aq)] -
[H+(aq) + Cl-(aq)] - 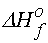 [HCl(g)]
[HCl(g)]yazabiliriz. Tablolardan
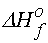 HCl(g) değeri - 92.30 kJ olarak bulunur. Eşitlik yeniden düzenlenirse
HCl(g) değeri - 92.30 kJ olarak bulunur. Eşitlik yeniden düzenlenirse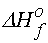 [H+(aq) + Cl-(aq)] = -75.14 kJ + (-92.30 kJ) = - 167.44 kJ
[H+(aq) + Cl-(aq)] = -75.14 kJ + (-92.30 kJ) = - 167.44 kJBöylece sulu çözeltideki H+ ve Cl- iyon çiftleri için standart oluşum entalpisi elde edilmiş olur.
Ayrıca asit, baz ve tuz çözeltilerinin reaksiyon entalpilerinden yararlanılarak iyon gruplarının standart oluşum entalpileri benzer şekilde hesaplanabilir.
Burada görüldüğü gibi elde edilen standart oluşum entalpisi iki iyonun birlikte ortaya koydukları
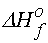 dir ve Tek iyonların standart oluşum entalpilerini elde etmek isteyebiliriz.
Birbirleriyle reaksiyon vermeyen elektrolitlerin seyreltik çözeltilerinde yapılan deneylerde, örneğin HCl ve KBr ün seyreltik çözeltileri karıştırıldığında hiç bir reaksiyon ısısı gözlenmez.
Bu nedenle yeterince seyreltik çözeltilerin reaksiyon entalpilerinden yararlanılarak istenen iyonun reaksiyon entalpisi hesaplanması mümkün olabilir.
Bununla beraber; pratik olarak tek bir iyon içeren reaksiyonlar mümkün olmadığından, iyonların standart oluşum entalpilerinin ölçülmesi mümkün olmaz.
Bu nedenle ölçülen standart iyonlaşma entalpileri diğer iyonların standart oluşum entalpilerine bağlı kalır.
Seyreltik sulu çözeltideki H+ iyonunun oluşum entalpisi sıfır olarak kabul edilir.
dir ve Tek iyonların standart oluşum entalpilerini elde etmek isteyebiliriz.
Birbirleriyle reaksiyon vermeyen elektrolitlerin seyreltik çözeltilerinde yapılan deneylerde, örneğin HCl ve KBr ün seyreltik çözeltileri karıştırıldığında hiç bir reaksiyon ısısı gözlenmez.
Bu nedenle yeterince seyreltik çözeltilerin reaksiyon entalpilerinden yararlanılarak istenen iyonun reaksiyon entalpisi hesaplanması mümkün olabilir.
Bununla beraber; pratik olarak tek bir iyon içeren reaksiyonlar mümkün olmadığından, iyonların standart oluşum entalpilerinin ölçülmesi mümkün olmaz.
Bu nedenle ölçülen standart iyonlaşma entalpileri diğer iyonların standart oluşum entalpilerine bağlı kalır.
Seyreltik sulu çözeltideki H+ iyonunun oluşum entalpisi sıfır olarak kabul edilir. 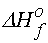 [H+(aq)] = 0
[H+(aq)] = 0 Böylece Cl- iyonu için 25 oC standart oluşum entalpisi
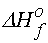 [Cl-(aq)] = - 167.44 kJ - 0 kJ = -167.44 kJ
[Cl-(aq)] = - 167.44 kJ - 0 kJ = -167.44 kJolarak hesaplanabilir.
Potasyum klorürün 25 oC deki sonsuz seyreltik çözeltisi için çözünme ısısı 17.18 kJ ve KCl(k) bu sıcaklıktaki standart oluşum ısısı - 435.87 kJ dür. Bu verilerden
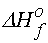 [K+(aq)] +
[K+(aq)] + 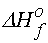 [Cl-(aq)] = 17.18 kJ + (-435.87 kJ) = - 418.69 kJ
[Cl-(aq)] = 17.18 kJ + (-435.87 kJ) = - 418.69 kJolarak elde edilebilir. klorür iyonunun standart oluşum entalpisi -167.44 kJ olduğundan, potasyum iyonunun sonsuz seyreltik çözeltideki standart oluşum entalpisi
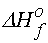 [K+(aq)] = -418.69 kJ - (- 167.44 kJ) = -251.25 kJ
[K+(aq)] = -418.69 kJ - (- 167.44 kJ) = -251.25 kJ olarak belirlenebilir.
Bu sonuç 25 oC de hidrojen iyonunun sonsuz seyreltik çözeltisindeki standart oluşum entalpisinin sıfır olarak kabul edilmesinin bir sonucu olduğu unutulmamalıdır.
Standart oluşum entalpilerinin nasıl kullanıldığını anlamak için Ca2+ iyonlarının bulunduğu çözeltiden CO2 geçirdiğimizi düşünelim. Bu durumda yazacağımız tepkime
Ca2+(aq) + CO2(g) + H2O(s) -----> CaCO3(k) + 2H+(aq)
olacaktır.
Tepkime için ;
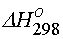 = 2
= 2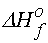 [H+(aq)] +
[H+(aq)] + 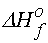 [CaCO3(k)] -
[CaCO3(k)] - 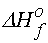 [Ca2+(aq)] -
[Ca2+(aq)] - 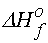 [CO2(g)] -
[CO2(g)] - 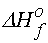 [H2O(s)]
[H2O(s)]yazabiliriz.
Tablo değerlerinden yararlanarak;
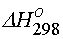 = 2x(0 kJ) + (-1206.87 kJ) - (-542.96 kJ) - (-393.51 kJ) - (285.84 kJ) = + 15.44 kJ
= 2x(0 kJ) + (-1206.87 kJ) - (-542.96 kJ) - (-393.51 kJ) - (285.84 kJ) = + 15.44 kJolarak elde edilir.