Termodinamik gözlemlere göre T= 0 değerine ulaştığında moleküller düzenli şekilde sıralandıkları durumdaki entropi değeri sıfırdır. Bu Nerst Isı teoremi olarak adlandırılır. Teoremi daha açık söyleyecek olursak, Sıcaklık sıfıra yaklaşırken, herhangi bir fiziksel veya kimyasal dönüşümde eşlik eden entropi değişimi sıfıra yaklaşır. (DT ---> 0 giderken DS ---> 0 dır.)
Bu yasanın deneysel ıspatına ilişkin örnek, ortorombik kükürt,S(a), ve monoklinik kükürt, S(b), arasındaki geçişin entropi değişimi dikate alınarak açıklanabilir. Bu olay için, 369 K deki geçiş entalpisi (-402 J mol-1) olarak hesaplanabilir.
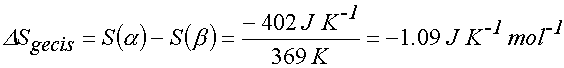
Ayrı ayrı entropiler T = 0 dan T=369 K arasındaki ısı kapasitelerinden hareketle bulunabilir. Bu şekilde elde edilen entropi değerleri
S(a) = S(a,0) + 37 J K-1 mol-1
S(b) = S(b,0) + 38 J K-1 mol-1
olarak elde edilir. Bu iki değer karşılaştırılırsa;
DSgeçiş=S(a,0) - S(b,0) -1 J K-1 mol-1
yazılabilir. Buradan teoreme göre ;
S(a) - S(b)
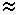 0
0 yazılabilir.
Nerst teoreminden izleyerek, T = 0 da gerçek kristal şeklindeki elementlerin entropileri sıfırdır. Tüm gerçek kristaller için T = 0 da entropilerin sıfır olması Termodinamiğin üçüncü kanunu ile özetlenebilir.
T = 0 da en kararlı halindeki herhangi bir elementin entropisi olacağından, bu nedenle herhangi bir maddenin entropisi pozitiftir.