Animasyon 1
BOHR TEORİSİNİN EKSİK TARAFLARI
Niels Hendrik Bohr, Rutherford atom modeli ile Planckın kuantum teorisini kullanarak 1913 yılında yeni bir atom modeli öne sürdü. Bu yeni model Rutherford modelinin açıklayamadığı noktalara ışık tutuyordu. Bohrun atom teorisi 3 temel varsayıma dayanır.
Bu yaklaşımlarla Bohr spektrumlardaki çizgileri ve Rutherford atom teorisinin açıklayamadığı diğer noktaları açıklamayı başardı
(Animasyon 1).|
Animasyon 1 |
Bohrun bu modeli H atomu, He+, Li+2, Be+3 iyonları gibi tek elektronl sistemlerin spektrumlarını kolyca açıklayabilmektedir. Bu tip türlerin atomik yarıçaplarının ne kadar olduğunu hesaplamaya çalışalım.
Elektron atom çekirdeği etrafında hareket ederken Coulomb çekme kuvveti ve merkezkaç kuvveti etkisi altındadır. Elektron sürekli aynı yörüngeyi izlediğine göre bu iki kuvvet birbirine eşit olmalıdır.
![]() (1)
(1)
Yukarıdaki eşitlikten r değeri
![]() (2)
(2)
olarak elde edilebilir. Ayrıca Bohr varsayımına göre bir elektronun açısal momentumu (mvr), ![]() nin katlarına bağlı değerler alacaktır.
nin katlarına bağlı değerler alacaktır.
![]() (3)
(3)
olup buradan ![]() ;
;
![]() (4)
(4)
kadar olacaktır.
Son bağıntı; 2 nolu bağıntıda yerine konursa;![]() (5)
(5)
bağıntısı elde edilmiş olur.
Atom çekirdeği etrafında dairesel yörüngelerde hareket eden elektronlar kinetik ve potansiyel enerjilere sahiptirler. Bu nedenle çekirdek etrafındaki elektronun enerjisi için
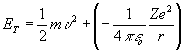 (6)
(6)
CGS sisteminde ![]() olduğundan
olduğundan
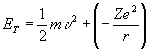 (7)
(7)
yazılabilir.
(1) nolu denklem hatırlanacak olursa;![]() (8)
(8)
ifadesi yazılabilir.
Bu da 7 nolu eşitlikte yerine konulacak olursa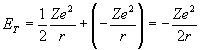 (9)
(9)
elde edilebilir. (5) nolu eşitlikteki r yerine konursa
![]() (10)
(10)
ifadesi elde edilebilir. Bu formül n nin çeşitli değerleri
için elektronların bulundukları enerji seviyesinde sahip olabilecekleri toplam enerjiyi verir.Bohrun ikinci varsayımını hatırlarsak elektronun enerji seviyesini değiştirmesi sırasında kaybedeceği enerji
![]() (11)
(11)
kadar olacaktır. Böylece
10 nolu denklemi kullanarak atomdan yayılan radyasyonun dalga boyu veya atom tarafından yutulacak dalga boyu kolayca hesaplanabilir. Dalga sayısıHidrojen atomu için
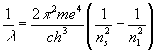
yazılabilir. Burada
BOHR TEORİSİNİN EKSİK TARAFLARI
Bohr modeli rutherforad atom modeline göre oldukça üstün tarafları olsa da bu kuramında eksik yönleri söz konusudur.
Elektronun, maddesel nokta şeklinde düşünüldüğünden, yörünce üzerinde enerji yayımlamadan dönüşleri, yörüngeden yörüngeye atlayışı ve açığa çıkan enerjinin ışıma halinde alınıp verilmesi açıklanması kolay olmayan bir durumdur.
Bohr atom modeli yalnızca tek elektronlu sistemlerin spektrumlarını açıklayabilir. Ve çok elektronlu sistemlerin spektrumlarıı açıklamakta yetersiz kalır. Çok elektronlu atomların spektrumlarında enerji düzeylerinin herbirinin iki ya da daha fazla düzeye ayrıldığı görülmektedir.
Yine hidrojen gazı, bir elektrik alanı veya magnetik alanda soğurma spektrumları incelenirse, enerji düzeylerinin çok elektronlu sistemlerde olduğu gibi iki ya da daha fazla enerji düzeyine ayrıldığı görülür.