ELEKTRONLARIN ATOMİK ORBİTALLERE DAĞILIMI
Schrödinger denkleminin (1, 2) çözümü elektronların orbitalere nasıl dağılacağı konusunda bilgi verir. Elektronların atomda çekirdek etrafında nasıl dizildiğini ve bunu belirleyen kuralları anlamak için atomdaki enerji düzeylerini ve bunları belirlemek için kullanılan kuantum sayılarını bilmek gerekir. Scrödinger denkleminin çözümüne göre bu kuantum sayıları baş kuantum sayısı n, yan kuantum sayısı l ve magnetik kuantum sayısı ml dir. Bu kuantum sayısından başka son bir kuantum sayısı ise spin kuantum sayısı s dir.
i. Baş Kuantum Sayısı (n) : Bohr kuantum kuramında olduğu gibi n; 1, 2, 3, ... değerleri alabilir. Sayıların yanısıra tabakaları göstermek için harflerde kullanılır. n = 1 ise bu birinci enerji seviyesini, n = 2 ise ikini enerji seviyesini gösterir.
|
Baş Kuantum Sayısı (n): |
1 |
2 |
3 |
4 |
5 |
... |
|
Tabakaları Gösteren Harfler : |
K |
L |
M |
N |
O |
... |
ii.
 Yan Kuantum
Sayısı (l) : baş kuantum sayısı ile tanımlanmış enerji seviyeleri daha alt
enerji seviyeleri içerirler. Bir enerji seviyesindeki alt enerji seviyelerinin
sayısı n - 1 tanedir. Örneğin n = 1
ise; alt enerji seviyelerinin l = 1 1 = 0 olup yoktur. Yani bir enerji
seviyesi vardır. n = 2 için ; l = 1- 2 = 1 olup bir alt enerji seviyesi
bulunması anlamına gelir. Bir başka deyişle 2 enerji seviyesi iki enerji
seviyesi bulundurur demektir. Bir tabakadaki tabakaların sayısı baş kuantum sayısına
eşittir. Alt tabakaları göstermek için harflerde kullanılır.
Yan Kuantum
Sayısı (l) : baş kuantum sayısı ile tanımlanmış enerji seviyeleri daha alt
enerji seviyeleri içerirler. Bir enerji seviyesindeki alt enerji seviyelerinin
sayısı n - 1 tanedir. Örneğin n = 1
ise; alt enerji seviyelerinin l = 1 1 = 0 olup yoktur. Yani bir enerji
seviyesi vardır. n = 2 için ; l = 1- 2 = 1 olup bir alt enerji seviyesi
bulunması anlamına gelir. Bir başka deyişle 2 enerji seviyesi iki enerji
seviyesi bulundurur demektir. Bir tabakadaki tabakaların sayısı baş kuantum sayısına
eşittir. Alt tabakaları göstermek için harflerde kullanılır.
|
Yan Kuantum sayısı (l): |
0 |
1 |
2 |
3 |
4 |
... |
|
Alt Tabakaları Gösteren Harfler : |
s |
p |
d |
f |
g |
... |
iii. Magnetik Kuantum sayısı (ml) : Her alt tabaka ise bir veya daha fazla orbitalden oluşmuştur. Herbir alt tabakadaki her bir yörünge magnetik kuantum sayısı ml ile gösterilir. Magnetik kuantum sayısının aldığı değerler - l ile + l arasında değer alırlar. Bu nedenle l = 0 ise ; ml = 0 değerini alır. l = 1 ise; ml = 0 , -1 , +1 değerlerini alır.
Enerji seviyeleri, alt enerji seviyeleri ve yörüngeler enerji düzeyleri için;
- Tabakların enerjileri, kuantum sayısı n artmasıyla artar.
- Kuantum sayısı n arttıkça tabakalar arasındaki enerji farkı azalmaktadır. 3. enerji seviyesinden başlayarak alt tabakalarının birbirlerine karıştığı gözlenir.
|
Baş Kuantum Sayısı |
Yan Kuantum Sayısı |
Magnetik Kuantum Sayısı ml |
Alt Tabakadaki Yörünge
sayısı |
||
|
n |
Tabaka |
l |
Alt tabaka |
||
|
1 |
K |
0 |
1s |
0 |
1 |
|
2 |
L |
0 1 |
2s 2p |
0 -1 0
+1 |
1 3 |
|
3 |
M |
0 1 2 |
3s 3p 3d |
0 -1 0
+1 -2 -1
0 +1 +2 |
1 3 5 |
|
4 |
N |
0 1 2 3 |
4s 4p 4d 4f |
0 -1 0
+1 -2 -1
0 +1 +2 -3 -2
-1 0 +1 +2 +3 |
1 3 5 7 |
iv. 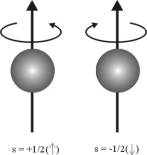
 Spin Kuantum Sayısı (s) : Yukarıdaki 3
kuantum sayısına ek olarak spin kuantum sayısı elektronun kendi ekseni
etrafında dönmesi sonucu ortaya çıkar ve dönme hareketinin 2 yönde olması
nedeniyle sadece iki değer alabilir. s = -1/2 ve s = +1/2 spin kuantum sayısı
atom spektrumlarında gözlenen çizgilerin incelikli yapısını açıklamak için
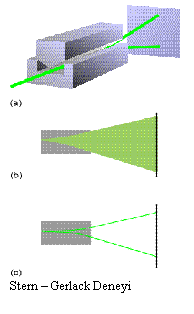
getirilen öneriler sonucu ortaya çıkmıştır. Bu öneri için denel kanıt, O. Stern
ve W. Gerlack tarafından verilmiştir. Deneyde, gümüş metal buharı ince bir
demet halinde güçlü bir magnetik alandan geçirilmiştir. Gümüş atomunda en dış
yörüngede bir tek elektron vardır ve magnetik alandan geçen gümüş atomlarının
iki yöne ayrıldıkları görülmüştür. Dönen yüklü tanecik magnetik özellik
gösterdiğinden elektron küçük bir mıknatıs gibi davranır ve elektronun ikğii
türlü dönme hareketi zıt yönlenmiş iki mıknatıs oluşturur. O halde spinleri zıt
olan elektronları taşıyan atomlar iki yöne saparlar.
Spin Kuantum Sayısı (s) : Yukarıdaki 3
kuantum sayısına ek olarak spin kuantum sayısı elektronun kendi ekseni
etrafında dönmesi sonucu ortaya çıkar ve dönme hareketinin 2 yönde olması
nedeniyle sadece iki değer alabilir. s = -1/2 ve s = +1/2 spin kuantum sayısı
atom spektrumlarında gözlenen çizgilerin incelikli yapısını açıklamak için
getirilen öneriler sonucu ortaya çıkmıştır. Bu öneri için denel kanıt, O. Stern
ve W. Gerlack tarafından verilmiştir. Deneyde, gümüş metal buharı ince bir
demet halinde güçlü bir magnetik alandan geçirilmiştir. Gümüş atomunda en dış
yörüngede bir tek elektron vardır ve magnetik alandan geçen gümüş atomlarının
iki yöne ayrıldıkları görülmüştür. Dönen yüklü tanecik magnetik özellik
gösterdiğinden elektron küçük bir mıknatıs gibi davranır ve elektronun ikğii
türlü dönme hareketi zıt yönlenmiş iki mıknatıs oluşturur. O halde spinleri zıt
olan elektronları taşıyan atomlar iki yöne saparlar.
Sonuç olarak bir atomdaki
herbir elektron dört kuantum sayısı; n, l, ml, s ile gösterilebilir
ve böylece elektronun bulunduğu yörünge ve dönme yönü belirlenebilir. Fakat
elektronların alabileceği kuantum sayılarına ilişkin bir kısıtlama vardır. Bu
Pauli ilkesi olarak bilinir. Buna göre; bir atomda, herhangi ikir elektronun
bütün kuantum sayıları birbirinin aynı olamaz en azından biri farklı olmak
zorundadır.örneğin bir yörüngeye ait n, l ve ml değerleri aynı ise bu yörüngeye
girecek elektronlardan birinin spini +1/2 ise diğer elektron ancak -1/2
değerini alabilir. Bu nedenle, herhangi bir yörüngedeki elektron sayısı ancak 2
olabilir demektir.
Elektron spini, atom ve
moleküller için gözlenen magenetik özelliklerin açıklanmasına yarar. Üç tür
magentik özellikten söz edilebilir. Bir bileşik, magnetik alan tarafından
çekilmez hatta hafifçe iteklenirse bu tür bileşiklerde spini bir yönde olan
elektronların sayısı spini diğer yönde olan elektronların sayısına eşit
demektir. Bu bileşikler diyamagnetik olarak adlandırılırlar. Magnetik
alan tarafından hafifçe çekilen bileşikler ise paramagnetik olarak
adlandırılır. Bu tür bileşiklerde spinleri bir yönde olan elektronların sayısı
spini diğer yönde olanların sayısından farklıdır. Ferromagnetik maddelerde
olarak adlandırılan diğer grup ise paramagnetik maddelerden daha güçlü olarak
magnetik alandan etkilenirler. Bu maddelerin en önemlisi demirdir.
ATOMLARDA ELEKTRON DİZİLİŞLERİ :
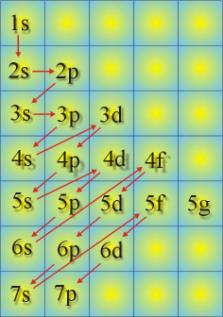 Elektronlar atomik orbitalleri doldurdukça kuantum
sayılarının durumuna göre atomun özelliklerini de belirlerler. Bu konuya daha
ayrıntılı olarak ilerleyen konularda değinilecektir. Atomik orbitallere
elektronların dağılımına ilişkin olarak kullanılabilecek bir çizim yanda
görülmektedir. Herbir orbitale girebilecek elektron sayısı belli olduğundan herhangi
bir atom numarası verilecek olursa o atom numarasına sahip atomun elektron
konfigürasyonu kolayca yazılabilir.
Elektronlar atomik orbitalleri doldurdukça kuantum
sayılarının durumuna göre atomun özelliklerini de belirlerler. Bu konuya daha
ayrıntılı olarak ilerleyen konularda değinilecektir. Atomik orbitallere
elektronların dağılımına ilişkin olarak kullanılabilecek bir çizim yanda
görülmektedir. Herbir orbitale girebilecek elektron sayısı belli olduğundan herhangi
bir atom numarası verilecek olursa o atom numarasına sahip atomun elektron
konfigürasyonu kolayca yazılabilir.
Bir atomun elektron konfigürasyonunu göstermek için (i) alt tabaka simgeleri üzerine içerdikleri elektron sayısı yazılabilir (ii) daha ayrıntılı olarak yörüngeleri kısa çizgi ve spinleri farklı elektronları bunun üzerine aşağı yukarı yönlü okla göstererek yazılabilir.
|
|
|
|
|
|
Elektron sayısı arttıkça dağılımdaki soygaz yapısına kadar tekrarlanan dağılımı göstermemek için kısaltmalar kullanılabilir.
|
|
|
Karbon atomunda 6 elektron bulunduğuna göre aşağıdaki elektron dağılımlarından hangisi kullanılmalıdır?
(1) ![]() veya
veya ![]()
(2) ![]() veya
veya ![]()
(3) ![]() veya
veya ![]()
Bunun yanıtı Hund kuralı ile verilebilir. Buna göre; en düşük enerjili veya temel haldeyken elektronlar n ve l kuantum sayıları aynı olan orbitalleri spin kuantum sayılarının cebirsel toplamı en büyük olacak şekilde doldururlar. Bu nedenle karbon atomunun elektron dağılımı 3 seçenek için doğrudur. Azottan neona kadar olan atomların elektron dağılımını
![]()
![]()
![]()
![]()
şeklinde yapabiliriz. Bazı atomların elektron dağılımları tam olarak yukarıda anlatılan kurallara uymayabilir. Bunlara örnek olarak 24Cr ve 29Cu dağılımı verilebilir.
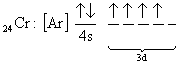
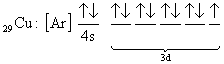
fakat yapılan deneysel çalışmalar yapılarının
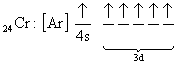
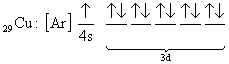
olarak bulunmuştur. Bu Jahn-Teller etkisi olarak adlandırılır. Buna göre; Eğer elektronlar dejenere enerji seviyelerini tam olarak dolduramazlarsa, dejenere olmayan enerji seviyelerindeki elektronlar kullanılır.
Elektron vermiş (iyonlaşmış) elementlerin elektron dizilişleri için enerji düzeyleri şeması kullanmak yanlışlığa yol açabilir. Örneğin demir atomunun iyonlaşması sonucu oluşacak elektron dağılımı;
26Fe :
1s2 2s2 2p6 3s2 3p6 4s2
3d6
26Fe :
1s2 2s2 2p6 3s2 3p6 3d6
4s2
[26Fe]+2
: 1s2 2s2 2p6 3s2 3p6 3d6
şeklindedir. Buradan da görüldüğü gibi iyonlaşma sonucu 3d elektronları değil 4s elektronları atomdan uzaklaşmıştır. Gerçekte de 3d elektronları ortalama olarak çekirdeğe 4s elektronlarından daha yakındırlar. Ve 4s elektronları daha kolay verilirler. Kural olarak iyonlaşma ile verilen elektronlar n sayısı en büyük olan elektronlardır. Bundan dolayı elementlerin elektron dizilişlerini enerji düzeyleri şemasına göre yazdıktan sonra alt tabaklarıı artan n sayısına göre düzenleyerek yeniden yazmak daha uygun olabilir. Örneğin 53[I] ve 53[I]- için;
[53I]
: 1s2 2s2 2p6 3s2 3p6 4s2
3d10 4p6 5s2 4d10 5p5
[53I]
: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5
[53I]
: [Kr] 4d10 5s2
5p5
[53I]-
: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6
[53I]-
: [Kr] 4d10 5s2 5p6
[53I]-
: [Xe]
Aynı elektron dizilişine sahip veya iyonlar izoelektronik olarak adlandırılırlar. Bu nedenle
[53I]- ve [Xe] izoelektroniktirler.