KİMYASAL
FORMÜLLERİN BULUNMASI :
Bir bileşiğin formülündeki
elementlerin belli oranlarda bulunduğunu ve buna göre bileşiğin formülünün
nasıl yazılacağını öğrendik. Fakat bir bileşiğin formülünün nasıl ortaya
çıkartıldığından buraya kadar söz etmedik. Bir bileşikteki elementlerin ve
elementlerin bileşik içinde hangi oranlarda bulunduğunun saptanması için bir
dizi kimyasal analiz yapmak gerekir. Böylece bileşik içerisindeki elementlerin
türleri ve birbirlerine göre oranları ortaya konabilir. Verdikleri bilgilere
göre formüller en basit formül, gerçek formül ve yapı
formül olmak üzere 3 grupta incelenebilir.
En Basit Formül : Bileşikteki
elementlerin atomların sadece göreli sayılarını veren formüle basit formül
denir. Örneğin; karbon ve hidrojenden oluşmuş bir bileşikteki hidrojen
atomlarınn karbon atomlarına sayısının oranının 2 olduğunu düşünelim. Bu
bileşik CH2, C2H4, C3H6 molekülü de olabilir ve bunların hem
kimyasal hem fiziksel özellikleri biribirinden farklıdır. Hatta (CH2)n
(n = 1, 2, 3, ....) olan bileşiklerin tümü olabilir demektir (örn 1).
Gerçek Formül
: Bileşik içindeki
atomların gerçek sayılarını gösteren formüllere gerçek formül adı verilir.
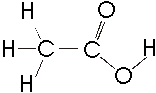
Örneğin; C2H2 molekülünde 2 hidrojen 2 karbon vardır ve
asetilen olarak bilenen bir gazdır (örn 1, 2).
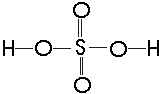
Yapısal Formül : Yapısal formülde
moleküldeki atomlar arasındaki bağlanma, çizgilerle gösterilir ve atomların
birbirlerine nasıl bağlandıkları hakkında bilgi verir. Yapısal formüllerin elde
edilişleri üzerinde daha sonra durulacaktır.
|
|
ÖRNEK : Bir gazın 2.34 g N ve 5.34 g O içerdiği
bulunmuştur. Bileşiğin basit formülü nedir? (O : 15.999 akb , N : 14.007
akb)
ÇÖZÜM : Herbir elementin bileşik içindeki mol
sayısını belirleyelim.
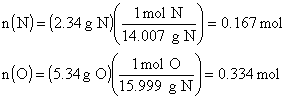
Bileşik içindeki
N ve O mol sayısı ![]() olmalıdır. Moleküldeki atom sayıları verilirken tam sayılar
halinde ifade etmek gerek çünkü molekül
içinde yarım veya kesirli atomlar olmaz. Bu nedenle basit formülü elde
ederken diğer sayılar en küçük olanına bölünebilir.
olmalıdır. Moleküldeki atom sayıları verilirken tam sayılar
halinde ifade etmek gerek çünkü molekül
içinde yarım veya kesirli atomlar olmaz. Bu nedenle basit formülü elde
ederken diğer sayılar en küçük olanına bölünebilir.
![]()
bileşiğin basit
formülüdür.
ÖRNEK : % 43.7 P ve % 56,3 O içeren fosfor
oksidin en basit formülü nedir? Molekül kütlesi 284 ise molekül formülü nedir?
(O : 15.999 akb , P : 30.974 akb).
ÇÖZÜM : 100 g. Bileşik temel seçersek, 100 g.
Bileşikteki atomların mol sayılarını bulabiliriz.
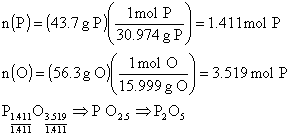
Bileşiğin en
basit formülü (P2O5) tir. Gerçek formülünde de elementlerin
mol oranları korunacağından gerçek formül (P2O5)X
şeklinde olmalıdır (X = 1, 2, 3, ...)
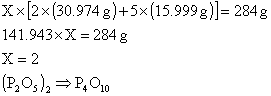
Bileşiğin gerçek
formülü P4O10 dur.
ÖRNEK : Kafein örneğinin yakma analizi sonucu
0.624 g C, 0.065 g H, 0.364 g N ve 0.208 g O içerdiği görülmüştür. Kafeinin mol
tartısı 194.0 g olduğuna göre gerçek formülü nedir? (H : 1.008 akb , O :
15.999 akb , C : 12.011 akb , N : 14.007 akb )
ÇÖZÜM : Her bir elementin mol sayısı; 0.052 mol
C
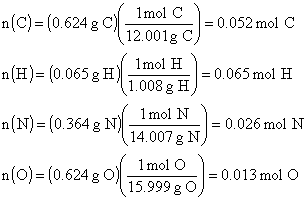
![]()
gerçek formülü
ise;
X ´ [4´(12.001 g) + 5´(1.008 g) + 2´(14.007 g) + 1´(15.999 g)] = 194.0 g
(97.057 g) ´ X= 194.0 g Þ X = 2
bileşiğin gerçek
formülü C8H10N4O2 dur.