KİMYASAL REAKSİYONLARDA HESAPLAMALAR
Kimyasal reaksiyonlarda reaksiyona giren maddeler tamamen tükenirse bu maddelerin stokiyometrik oranda olduğunu söyleriz. Fakat çoğu zaman, tepkimeye giren türler birbirlerini tamamen tüketecek miktara sahip değillerdir. Reaksiyon sırasında tüm reaktifler tükenmeden önce reaktiflerden biri tükenebilir. Bu reaksiyonun sona ermesi demektir. Tükenmesiyle reaksiyonun sona ermesine neden olan bileşik sınırlayı reaktif olarak adlandırılır (örn. 1).
Bazı reaksiyonlarda ise reakiyona giren maddelerde safsızlık bulunabilir. Hesaplamalar sırasında buna dikkat edilmelidir (örn. 1). Bazen ise beklenen miktara göre daha az ürün ele geçebilir. Reaksiyondan beklenen verime teorik verim denir. Reaksiyonun beklenen verimle gerçekleşmemesinin nedeni;
- Reaktiflerin tam olarak reaksiyona girmemesi,
- Reaktiflerin istenen tepkimeler dışında tepkime vermesi sonucu yan ürünler meydana getirmesi,
- Beklenen ürün farklı tepkimeler vererek başka ürünlere dönüşmesi,
- Kurutma, saflaştırma v.b. nedenlerle elde edilen ürünün bir kısmı kaybolması
Olabilir. Reaksiyonun yüzde verimi ise
![]()
eşitliğinden belirlenebilir (1).
ÖRNEK : 23.5 g C2H6 95.4 g Oksijen bulunan kapalı bir kapta yakılıyor. Sınırlayıcı reaktifi ve kaptaki herbir bileşiğin ne kadar olduğunu hesaplayınız (C2H6 = 30.0 g/mol, O = 16 g/mol).
ÇÖZÜM :
![]()
23.5 g C2H6 yı tüketecek O2 miktarını hesaplayalım.
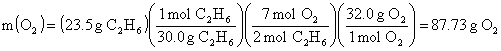
Buradan da görüldüğü gibi 23.5 g. C2H6 yı tüketmek için 87.73 g O2 ihtiyaç varken kapta fazla oksijen vardır. Bu nedenle reaksiyonu sınırlayan bileşik C2H6 dır.
Kapta kalacak maddeler ve miktarları;
![]()
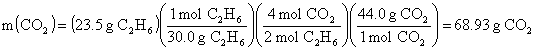
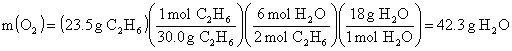
ÖRNEK : İçerisinde % 18 oranında halkoprit (CuFeS2 veya Cu2S×Fe2S3) minerali bulunan bakır filizinden saf bakır elde edilirken işlemler sıranda bakırın %10 kaybedilmektedir. Buna göre 1 ton filizden ne kadar bakır elde edilebilir (Cu : 63.54 akb. Fe : 55.85 akb S : 32.066).
ÇÖZÜM :
M(CuFeS2) = 1´(63.54 akb)+ 1´(55.85 akb)+ 2´(32.066 akb)=183.522 akb
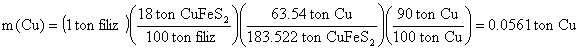
1 ton filizden 56.1 Kg bakır elde edilebilecektir.
ÖRNEK : Asitli ortamda etil alkolün aşırısının bulunduğu ortama %99 luk 10 mL CH3COOH katılarak 12.5 g CH3COOC2H5 elde ediliyor. Reaksiyonun % verimini hesaplayınız (d(CH3COOH =1.05 g/cm-3), C : 12.0 akb., H : 1.0 akb, O : 16.0 akb.).
ÇÖZÜM :
![]()
M(CH3COOH) = 2´(12.0 akb.) + 4´(1.0 akb) + 2´(16.0 akb) = 60 akb.
M(CH3COOC2H5) = 4´(12.0 akb.) + 8´(1.0 akb) + 2´(16.0 akb) = 88 akb.
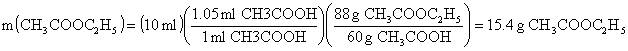
![]()