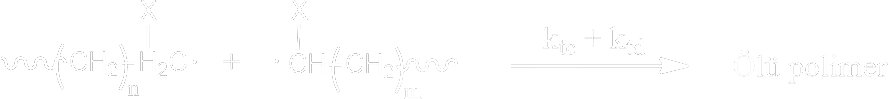Radikal Zincir (Katılma) PolimerizasyonuKatılma polimerizasyonun en önemli tiplerinden biri çiftleşmemiş elektron içeren elektriksel olarak nötral serbest radikallerle başlatılan polimerizasyondur. Bu tip polimerizasyonda doymamış monomerler tipik zincir reaksiyonu verirler. Süreç plastik endüstrisinde vinil polimerizasyonu olarak bilinir. Polimerizasyon, basit gaz fazı zincir reaksiyonları için kullanılan ultraviole radyasyon aktivasyon yöntemi kullanılarak başlatılabilir. Reaksiyon geciktirici (retardation) ve inhibitörlerden kolayca etkilenir. Tipik bir zincir polimerizasyonunda başlatıcı etkisi binlerce monomer molekülünün polimerizasyonuna neden olabilir. Zincir polimerizasyonunun bazı karakteristiklerinden daha önce söz etmiştik (1). Polimerizasyonda, zincirin büyümesi aktif merkez içeren zincire pekçok monomerin katılmasıyla büyür. Aktif merkez katyonik, anyonik ve serbest radikaller içerebilir. fakat bu kısımda yalnızca serbest radikal polimerizasyonundan bahsedeceğiz. 1937 de Flory radikalik polimerizasyonun kesin şekilde başlama, ilerleme ve sonlanma adımları üzerinden ilerlediğini gösterdi. Karbon-karbon çifte bağının göreli olarak düşük kararlılığa sahip olması nedeniyle, özellikle serbest radikallerle kolayca tepkime verebilir. \rm H_2C=CHX ve \rm H_2C=CXY şeklindeki vinil monomerleri olarak adlandırılan bileşiklerdeki çifte bağ ile radikalin tepkimesi söz konusu olur. Başlama (Initiation) : Radikalik polimerizasyonun başlaması için gerekli olan radikaller termal olarak ortaya çıkabildikleri gibi radyasyon etkisi veya kimyasal olarak ortaya oluşabilirler. Termal Başlama : Monomer moleküllerin bazıları ortamın sıcaklığına bağlı olarak belli bir kinetik enerji ile hareket ederlerken yeterince enerjitik olanlar uygun çarpışmalarla aktifleşmiş hale gelebilirler. \rm M \; + \; M \; \rightarrow \; M \; + \; M^*
Elbette bazı olaylardaki serbest bir radikalden ziyade, sadece çok enerjitik bir molekül olabilir. Fakat pekçok zincir reaksiyonu, gerçekte, daha sonra serbest radikallerin ortaya çıktığını gösterir. Işık ya da başlatıcı maddelerle gerçekleştirilen polimerizasyonların, muhtemelen sadece termal çarpışmalarla gerçekleştiği ve radikallerin sadece zincir taşıyıcı olduğu görülür. Gerçek bir termal polimerizasyonun olup olmadığı sorusu sorulabilir. Polimerizasyonların serbest radikal oluşturma kabiliyetinde olan safsızlıkların küçük miktarı ile, özellikle peroksitlerle, başlamadığını kanıtlamak bir dereceye kadar zordur. Moureu ve Dufraisse (1922), oksijenin varlığı ile ortaya çıkan peroksitlerin küçük miktarlarının, vinil monomerlerini hava etkisi ile polimerleştirdiklerini göstermişlerdir. Fikirlerinin gücünü; en saf monomerlerde bile ortaya çıkan vinil polimerizasyonunda, aktif merkezlerin kendiliğinden termal oluşumu asla meydana gelmediğinden almışlardır. Benzer bir görüş Norrish ve Brookmann (1939), tarafından ifade edilmiştir. Diğer taraftan, Walling C. ve çalışma arkadaşları (1946b), başlatıcı maddelerin bulunmadığını düşündükleri stirenin polimerizasyonu üzerinde durmuşlar ve uygun reaksiyon hızlarına sahip olduğunu göstermişlerdir. Bu görüş metil metakrilat içinde ayrıca gösterilmiştir (Walling C. ve Brigg E.R., 1946a ). Bu olaylarda termal bir polimerizasyonun olduğu akla oldukça yakın görünmektedir. Diğer yandan saf vinil asetatın polimerleşmeye çok dirençli olduğu bulunmuştur (Cuthbertson, A.C. et all., 1939). Monomerin termal aktivasyonunun doğası hala bilinmiyor. Staudinger (1932), çifte bağın monomerik bir diradikal şeklinde açıldığını önermiştir. \rm RCH=CH_2 \; \rightarrow \; R \dot C- \dot CH_2
Buradaki noktalar çiftleşmemiş elektron çiftlerini gösterir. Diradikal daha sonra monomere katılır ve her iki uçtan büyür. Staudinger (1936), tarafından önerilen ilk görüşe göre radikal oluşumu, \rm RCH=CH_2 \; + \; R \dot C- \dot CH_2 \; \rightarrow \; R \dot CH- CH_2 CHR \dot CH_2
şeklindedir. Dimerik bir diradikal monomer moleküllerinin çarpışmaları ile oluşabilir (Walling C. et all., 1946b). \rm 2RCH=CH_2 \; \rightarrow \; R \dot CH- CH_2 CHR \dot CH_2
Bu diradikal heriki uçtan ayrı ayrı büyüyebilir. Çünkü heriki öneri de monomer moleküllerinin bimoleküler bir reaksiyonu içerdiğini gösterir ve bu iki olay arasındaki farkı deneysel olarak ayırt etmek zordur. Herhangi bir olayda, başlama sürecinin bimoleküler doğası polimerizasyon kinetikleri ile saptanmıştır (Walling C. et all., 1946b). Termal polimerizasyon kinetiği için başlama reaksiyonuna ilişkin eşitlik; \rm r_i = k_i[M]^2
şeklinde verilebilir. Eşitlikten de görüldüğü gibi termal başlamaya ilişkin hız sabiti monomer konsantrasyonuna ikinci dereceden bağımlılık gösterir. Fotokimyasal Başlama : Polimerizasyon elektromagnetik radyasyonla da başlatılabilir. \rm M \; + \; \nu \; \rightarrow \; M^*
\rm M^* türünün tam doğası, termal başlamada olduğu gibi, şüphelidir. Fakat her ne kadar bir soru işareti içerse de genelde bir diradikal olarak düşünülür. Fotokimyasal başlatma emülsiyon polimerizasyonunda kullanılamamıştır fakat temel polimerizasyon çalışmalarında çok önemlidir. Kullanılan radyasyonun şiddeti ne kadar fazla olursa, radyasyonla etkişelerek aktiflenecek monomerlerin sayısıda o kadar fazla olacaktır. Bu nedenle başlama hızı için; \rm r_i = k_i^'[M]I
Burada I; \rm \nu frekansındaki radyasyonun şiddetidir. Kimyasal Başlama : Termal polimerizasyon; esasen akademik olarak ilginçtir. Pratikte, polimerizasyonlar radyasyonla ya da daha basit olarak serbest radikal veren reaktif başlatıcı maddeler ya da sistemlerle başlatılır. Serbest radikal üreten maddelerle başlatılan polimerizasyonlar termal polimerizasyondan daima çok daha hızlıdır. Bu gerçekte, Bu tip olaylardaki sürecin gerçekten serbest radikaller ile başladığının en güçlü kanıtıdır. Serbest radikaller, çifte bağdaki elektronlarından biri ile monomere bağlanırken, diğer elektronun çiftleşmemiş olarak ayrıldığı kabul edilmiştir. Olay stiren için aşağıda gösterilmiştir. \rm R \cdot \; + \; C_6H_5CH=CH_2 \;\rightarrow \; C_6H_5 \dot CH-CH_2R
Olaya ilişkin İlk kanıtı, Price ve çalışma grubu (1941), stiren ve metil metakrilatın, p-bromobenzoil peroksit, anisol peroksit, ve kloroasetil peroksiti başlatıcı olarak kullanıp gerçekleştirdikleri, polimerizasyonda halojen veya metoksit gruplarının polimere kimyasal olarak bağlandığını göstermişlerdir. Polimer molekülü başına 0.5 den 2.5 kadar başlatıcı parçası bulmuşlardır. Daha sonraki araştırmalarda 3,4,5-tribromobenzoil peroksit kullanılmış ve polimer molekülü başına yaklaşık bir tribromofenil grubu bulunmuştur (Price C.C., Tate B.E. 1943). Smith ve Campbell (1947) stiren emülsiyonda polimerleştiği zaman anorganik başlatıcıların kalıntılarını benzer şekilde göstermişlerdir. Küçük bir miktarda radyoaktif \rm S^{35} içeren potasyum persülfat kullanarak göstermişlerdir. \rm I_2 şeklindeki bir başlatıcı, ısı, ışık ya da bulunduğu ortamın doğasına bağlı olarak, aşağıdaki şekilde parçalanabilir. \rm I_2 \;\rightarrow \; 2I \cdot
Başlatıcının parçalanması için radikal üreme hızı;
\rm r_d = 2k_df[I_2]
olup, burada, \rm k_d; başlatıcı parçalanmasına ilişkin hız sabiti, f; başlatıcının etkinlik faktörü, \rm [I_2]; başlatıcı konsantrasyonudur. Oluşan başlatıcı radikallerinin monomerlerle tepkimesi için; \rm I \cdot \; + \; M \; \rightarrow \; IM \cdot
ve kinetik eşitliği için; \rm r_i = k_i[I \cdot] [M]
yazılabilir. Ayrıca \rm r_i=r_d dir. Eğer sıcaklığın polimerizasyon hızına katkısınıda dikkate alacak olursak, \rm r_i = r_d = k_i[I \cdot] [M] + r_{i (termal)}
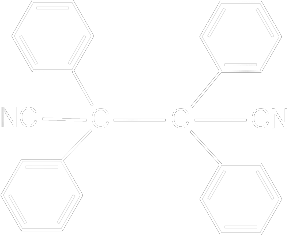
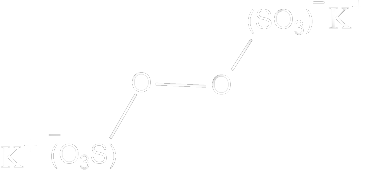
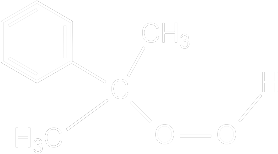
yazılabilir. Başlatıcı Sistemleri Parçalanmaya Dayalı Başlatıcılar : Pekçok bileşiğin parçalanması sonucu serbest radikallerin oluştuğu iyi bilinir. Bu tip parçalanmalarda radikallerin oluşumu polimerizasyona dayalı olmadan kinetik analizlerle, çözeltilerdeki magnetik alınganlık değişikliklerinin ölçülmesiyle belirlenmiştir. Bu tip bileşikler genel olarak polimerizasyonların başlatılmasında kullanılır. Bu bileşikler genelde simetrik bir yapıya sahiptirler. bunlardan dördü aşağıda gösterilmiştir.
Azo ve Diazo ve tiyoeter Bileşikleri : Özellikle kütle ve çözelti polimerizasyonunda kullanılabilir. Bu bileşik (II) termal olarak birinci derece bir reaksiyon kinetiği ile kantitatif olarak azot ve (monomer yokken) tetrametilsüksinodinitril vermek üzere parçalanır.
tiyoeterlerde azo bileşiklerinde olduğu gibi birinci mertabe parçalanma kinetiği gösterirler. Bu tip bir bileşiğin radikalik parçalanması aşağıda verilmiştir.
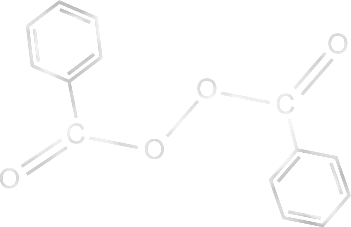
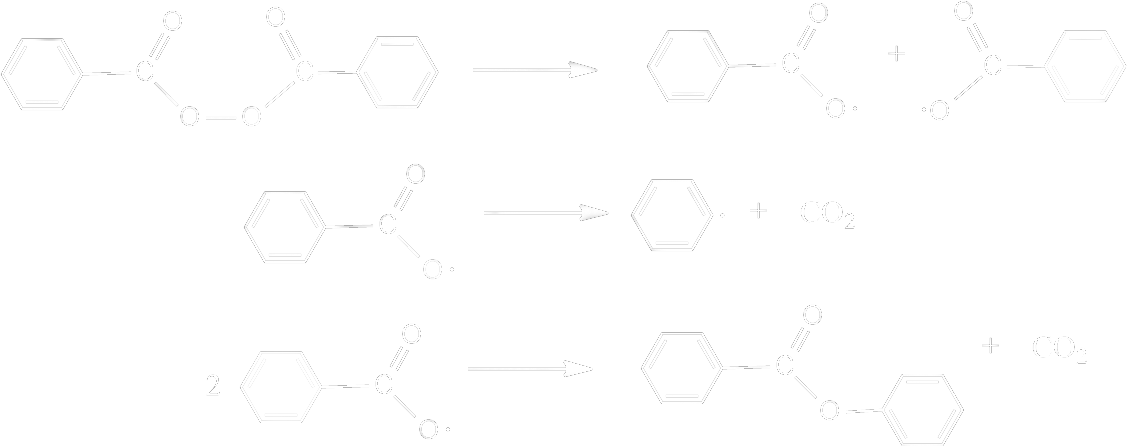
Peroksijen Bileşikleri : Gerek endüstriyel, gerekse temel araştırmalarda üstün kimyasal başlatıcılar arasında peroksi bileşikleri yer alırlar. Bu bileşiklerde O-O bağı içerirler. Hidrojen peroksit, HOOH, deki hidrojen atomlarından biri veya ikisi çeşitli anorganik veya organik radikallerle yer değiştirir. Monosübstitüe hidrojen peroksit asidin gücüne bağlı olarak hidroperoksit veya per asit olarak adlandırılır. Peroksit terimi ise disübstitüe bileşikler için kullanılır. Disübstitüe peroksitler genel olarak hidroperoksitlere göre ısıyla daha kolayca parçalanırlar. Bu davranışta elektronik etkiler rol oynasa da sterik faktörler önemlidir. Örneğin ; benzer bileşikler olan benzoil peroksit (V) ve bisfenilasetilperoksit (VI) buna örnektir. İkinci bileşik 0 \rm ^oC de parçalanırken, birincisi 70 \rm ^oC de parçalanır. tiyoeterlerde azo bileşiklerinde olduğu gibi birinci mertabe parçalanma kinetiği gösterirler. Bu tip bir bileşiğin radikalik parçalanması aşağıda verilmiştir.
Diğer taraftan hidroperoksitler peroksitlere göre daha reaktiftirler. Örneğin aynı şartlar altında a-cumly peroksit (VII) iyotu yükseltgenmezken, a-cumyl hidroperoksit (cumene hydroperoxide) (VIII) yükseltger.
Benzoil peroksit yağda çözünebilir başlatıcılarla çalışılırken kullanılır. Benzoil peroksit en basit diarilperoksit olup, 70-90 \rm ^o C de ısıtıldığında, fenil radikalerini oluşturacak benzoat radikallerine parçalanır.
Potasyum Persülfat : Emülsiyon polimerizasyonu ile üretilen polimerlerin en büyük kısmı belki de diğer başlatıcılardan daha çok potasyum persülfat kullanılarak hazırlanır. Sulu çözeltide (alkali, nötral veya bazik) persülfat stokiyometrik olarak \rm S_2O_8^= \; + \; H_2O \; \rightarrow \; 2HSO_4^- \; + \; {1 \over 2} O_2
denklemine göre oksijen ve bilsülfata parçalanır. Kuvvetli asit varlığında Caro's asidi (monopersülfürik asit) \rm H_2S_2O_8 \; + H_2O \; \rightarrow \; H_2SO_5 \; + \; H_2SO_4
denklemine göre oluşur. Monopersülfürik asit hidrojenperoksit ve sülfürik asit vermek üzere \rm H_2SO_5 \; + H_2O \; \rightarrow \; H_2O_2 \; H_2SO_4
şeklinde parçalanır. Persülfat iyonunun parçalanması için \rm S_2O_8^= \; \rightarrow \; 2SO_4 ^- \cdot
\rm S_2O_8^= \; + \; H^+ \; \rightarrow \; HS_2O_8^- \cdot \; \rightarrow \; SO_4 \; + \; HSO_4^-
Persülfat radikallerinin monomer ile tepkimesi
şeklinde gerçekleşir. Hidrojen Peroksit - Demir (II) iyonu : Redoks sistemin mekanizmasını kavramak için H2O2 - Fe (II) sistemini ele alacağız. İlk olarak 1932 de Haber ve Weiss sulu çözeltide redoks çiftinin reaksiyonu ile serbest radikallerin nasıl oluştuğunu açıklamıştır. \rm H_2O_2 \; + \; Fe^{+2} \; \rightarrow \; HO \cdot \; + \; OH^- \; + \; Fe^{+3}
oluşan hidroksil radikali nedeniyle sonradan oluşan reaksiyonlar ise; \rm Fe^{+2} \; + \; HO \cdot \; \rightarrow \; Fe^{+3} \; + \; OH^-
\rm H_2O_2 \; + \; HO \cdot \; \rightarrow \; H_2O \; + \; HO_2 \cdot
\rm Fe^{+2} \; + \; HO_2 \cdot \; \rightarrow \; Fe^{+3} \; + \; HO_2^-
\rm Fe^{+3} \; + \; HO_2 \cdot \; \rightarrow \; Fe^{+2} \; + O_2 \; + \; H^+
şeklindedir. Persülfat Redoks Sistemleri : Persülfat; disübstitüe bir perosit olarak düşünülürse, hidrojen peroksit sistemindeki tepkimelere benzer tepkimelerle Fe (II) iyonlarıyla tepkime verir. \rm S_2O_8^= \; + \; Fe^{+2} \; \rightarrow \; SO_4^- \cdot \; + \; SO_4^{-2} \; + \; Fe^{+3}
\rm Fe^{+2} \; + \; SO_4^- \cdot \; \rightarrow \; Fe^{+3} \; + \; SO_4^{-2}
\rm SO_4^- \cdot \; + \; CH_2=CHX \; \rightarrow \; \text{ katılma ürünü }
ortamdaki çözücü ile \rm CH_3OH \; + \; SO_4^- \cdot \; \rightarrow \; HSO_4^- \; + \; \cdot CH_2OH \; veya \; ( CH_3O \cdot )
şeklinde tepkimeler meydana gelebilir. 1940 yıllarında Bacon sulu çözeltide, akrilonitrilin persülfatla başlatılmış polimerizasyonunda pekçok indirgeme ajanı kullanılabileceğini gösterdi. Organik indirgeyici olarak piragallol, hidrokinon, tiyoglikolik asidi, metal tozu olarak demir, bakır ve gümüşü, metal iyonu olarak kalay, bakır, titan ve gümüş iyonlarıda indirgeme ajanı olarak kullanılabileceğini gösterdi. Bu amaçla kullanılabilecek azotlu ve kükürtlü bileşikler ise; hidrazin, hidroksiamin, sodyum bisülfit, sodyum sülfür gibi türlerdi. İlerleme ( Propagation ) : Serbest bir radikalin vinil monomere katılması için 2 olası durum söz konusudur. \rm R \cdot \; + \; H_2C=CHX \; \rightarrow \; R-CH_2- \dot CHX \qquad (I)
\rm R \cdot \; + \; H_2C=CHX \; \rightarrow \; R-CHX- \dot CH_2 \qquad (II)
yukarıdaki reaksiyonlardan kararlı ürün hangisi ise onun oluşma ihtimali daha yüksektir. Çiftleşmemiş elektron X ile konjugasyona girebilecekse I, aksi taktirde II yapısı reaksiyonu gerçekleşir. Sterik faktörler nedeniyle de I reaksiyonu daha olasıdır. Reaksiyonun ilerlemesi sırasında monomer zincir aşağıdaki şekilde görüldüğü gibi Baş-Kuyruk, Baş-Baş veya Kuyruk-Kuyruk birleşmesiyle ilerleyebilir. Her iki tip zincir içerisinde rastlantısal olarak tekrarlanabilir.
Çoğalma aşaması; monomer radikaline diğer monomerlerin katılması aşamasıdır. Bu reaksiyonlardaki hız sabitinin değeri, pek çok kimyasal reaksiyon hız sabitine göre oldukça fazladır. \rm IM \cdot \; + \; M \; \rightarrow \; IMM \cdot
\rm IMM \cdot \; + \; M \; \rightarrow \; IMMM \cdot
\rm IMMM \cdot \; + \; M \; \rightarrow \; IMMMM \cdot
... \rm I(M)_{n-1} \cdot \; + \; M \; \rightarrow \; I(M)_n \cdot
yazılabilir. Kinetik eşitlik ise \rm r_p = k_p[M][R \cdot ]
Buradaki \rm R \cdot terimi ortamdaki her tür radikalin konsantrasyonudur. Sonlanma (Termination) : Radikallerin ortadan kalkma aşaması ise; sonlanma aşaması olarak adlandırılır ve sonlanma için iki olası yol söz konusu olabilir. Birleşme İle Sonlanma ( Combination ) : Bu sonlanmada iki zincir birleşerek sonlanma gerçekleşir.
\rm
Orantısız Sonlanma ( disproportionation ) : Hidrojen transferi ile iki polimer molekülü meydana gelir.
Sonlanma nasıl olursa olsun, sonuçta ölü polimerler meydana gelir.
Sonlanma hız sabiti, \rm k_t için; \rm k_t = k_c+k_d yazılabilir. Böylece terminasyon hızı için, \rm r_t=2k_t[R \cdot]^2
yazılabilir. Eşitlikte de görüldüğü gibi ortamdaki radikal konsantrasyonu ne kadar fazla olursa, radikal moleküllerin sonlanma hızları o derece fazla olacaktır. Böylece bu oluşacak polimerin mol tartısı radikal konsantrasyonunun artması ile azalır. Ayrıca reaksiyon tüm reaksiyonlar düşünülecek olursa; radikaller kararlı hal konsantrasyonuna ulaşmış olur. Bu nedenle radikallerin oluşumu ile tükenme hızının değişmeyeceği düşüncesiyle \rm r_i = r_d = 2k_t[R \cdot ]^2
yazılabilir. \rm r_d değerinin \rm r_d=2k_df[I_2]
olduğu hatırlanacak olursa, reaksiyon ortamındaki radikal konsantrasyonu için; \rm [R \cdot]^2 = { 2 k_d f [I_2] \over 2k_t }
\rm [R \cdot] = \sqrt { { 2 k_d f [I_2] \over 2k_t } }
yazılabilir. Polimerizasyon hızının değişimi ele alınacak olursa radikal konsantrasyonu \rm r_p=k_p[R \cdot][M]
eşitliğinde yerine konursa \rm r_p = k_p \sqrt { { 2 k_d f \over 2k_t } } [I_2]^{ 1 / 2} [M]
elde edilebilir. Polimerizasyon hız sabiti K ; \rm K = k_p \sqrt { { 2 k_d f \over 2k_t } }
olarak tanımlanacak olursa; polimerizasyon ilerleme hız \rm r_p = K [I_2]^{ 1 / 2} [M]
olarak yazılabilir. Polimerizasyon derecesi ve Zincir transferi Kinetik zincir uzunluğu \rm \nu ; aktif merkez başına kullanılan monomerlerin sayısı olarak tanımlanır. \rm { r_p \over r_i } = { r_p \over r_d }
olduğundan; \rm \nu = { k_p \over 2k_t } { [M] \over [R \cdot ] }
yazabiliriz. yukarıda elde ettiğimiz radikal konsantrasyonu bu son denklemde yerine konulursa; \rm \nu = { k_p^2 \over 2k_t } { [M]^2 \over r_p }
ifadesi elde edilebilir. Kinetik zincir uzunluğu polimerizasyon derecesi \rm \overline{DP}_n ile ilişkilidir. n; polimer zincirindeki tekrarlanan birim sayısı olmak üzere, birleşme ile sonlanma söz konusu olursa \rm \overline{DP}_n =2 \nu , orantısız sonlanma söz konusu ise \rm \overline{DP}_n = \nu olacaktır. Bu bazı sistemler olarak tam olarak doğrudur. Fakat polimerizasyon süreçlerinin çoğunda bu beklentiden sapmalar meydana gelir. Bunun nedeni zincir-transfer reaksiyonlarıdır. \rm M_x \cdot \; + \; P \; \rightarrow \; M_x \; + \; P \cdot
\rm P_x \cdot \; + \; M \; \rightarrow \; PM \cdot
Burada P, monomer, başlatıcı, çözgen, veya ortama katılmış zincir tranferci bir madde olabilir. Polimere zincir transferi ihmal edilir. Çünkü bu şekilde yeni polimer molekülü oluşumu meydana gelmez. Bu nedenle polimerizasyon derecesi için; \rm \overline{DP}_n = { \text{ Büyüme Hızı } \over \text{ Zincir Sonlarının Oluşma Hızı }}
\rm \overline{DP}_n = { r_p \over k_df[I_2] + k_{tr,M}[M][R \cdot] + k_{tr,S}[S][R \cdot] + k_{tr,I}[I_2][R \cdot] }
yazılabilir. Burada sırasıyla monomere, çözgene, başlatıcıya zincir transferini gösterir. Eğer sonlanma orantısı sonlanma ile meydana geliyorsa ilk terim \rm 2k_df[I_2] olur. Transfer sabitleri; \rm
C_M = { k_{tr,M} \over k_p} \qquad
C_S = { k_{tr,S} \over k_p} \qquad
C_I = { k_{tr,I} \over k_p} \qquad
şeklinde belirlenirse; \rm { 1 \over \overline{DP}_n } = { k_t \over k_p ^2} { r_p \over [M]^2 } + C_M + C_S { [S] \over [M] } + C_I { k_t \over k_p ^2 k_df} { r_p^2 \over [M]^3}
yazılır.
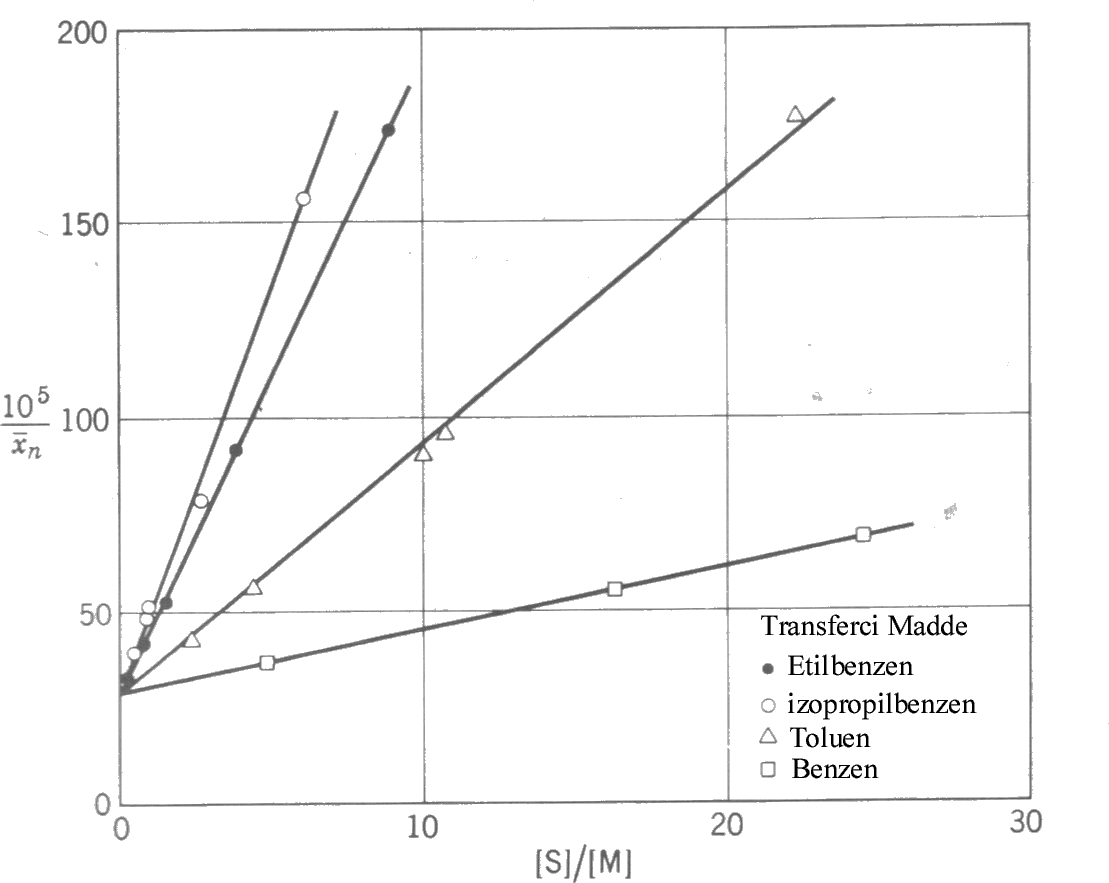
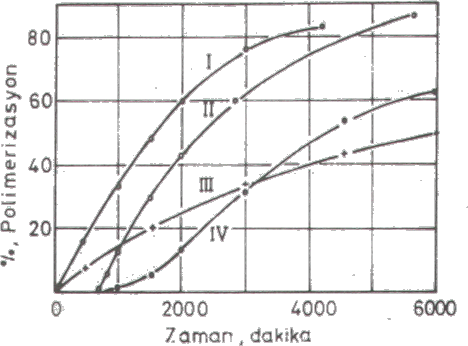
Çözgene Zincir Transferi : Çözgen olan bir polimerizasyon sisteminde, diğer parametreler değişmeyeceğidüşüncesi ile yukarıdaki eşitlik \rm { 1 \over \overline{DP}_n } = \Big( { 1 \over \overline{DP}_n } \Big)_o + C_S { [S] \over [M] }
şekline indirgenebilir. Buradaki \rm \Big( { 1 \over \overline{DP}_n } \Big)_o ; polimerizasyona ve monomere zincir taransferine katkıyı içerir. Eşitlikten de görüldüğü gibi \rm { 1 \over \overline{DP}_n } , [S]/[M] ile doğrusal olarak değişir. Polistirenin polimerizasyon derecesi üzerine solvente zincir transfer etkisi yandaki şekilde gösterilmiştir. Monomer ve Başlatıcıya Zincir Transferi : Eğer ortamda çözücü yoksa, çözücüye zincir transferi de yok demektir. Bu durumda başlatıcıya ve monomere zincir transferi söz konusu olabilir. Eğer başlatıcıya zincir transferi yoksa \rm C_I=0 olur. \rm rp^2 ye karşı \rm { 1 \over \overline{DP}_n } değişimi doğrusal değişim gösterir. Fakat başlatıcıya zincir transferi söz konusu olursa bir parabol elde edilir. İstenilen moleküler ağırlığı sahip polimerleri elde edebilmek için molekül ağırlığının denetlenmesi de bu şekilde düzenleyici (regülatör) maddeler katılarak sağlanabilir.
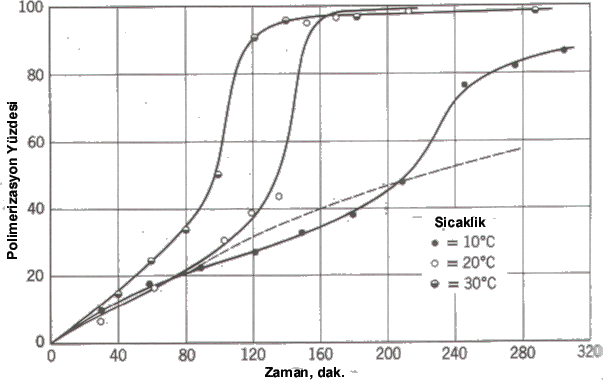
Polimerizasyonu Önleyici ve Geciktirici Maddeler Polimerizasyon ortamına bazı maddelerin katılmasıyla monomerlerin polimerleşmesi yavaşlatılır veya durdurulur. Bu tür maddeler zincir başlatıcı radikallerle veya büyümekte olan zincir radikallerle tepkime vererek bunları radikal olmayan moleküllere veya etkinliği düşük radikallere dönüştürür. Polimerizasyon hızını sıfıra düşüren maddelere önleyici, polimerizasyonu tamamen önlemeyen fakat reaksiyon hızını azaltan maddelere geçiktirici denir. Bir inhibitöre zincir transferci madde olarak bakılabilir. Alttaki şekilde stirenin termal polimerizasyonuna önleyici ve geciktirici maddelerin etkisi gösterilmiştir. Radikal Polimerizasyonun İlerlemesi ( Özivme ) Serbest radikal zincir reaksiyonlarında genel olarak başlatıcı konsantrasyonu reaksiyon süresince pek fazla değişmez. Bu nedenle; başlatıcı etkinliği monomer konsantrasyonuna bağlı değilse, monomerin polimere dönüşmesi birinci mertebeden bir kinetiğe sahip olmalıdır. Öte yandan serbest radikal polimerizasyonunda reaksiyon ilerlerken polimerizasyonun ilerlemesi nedeniyle monomer konsantrasyonu azalacağı için, reaksiyon hızında yavaşlama beklenir. Oysa durum beklenenin tam tersidir ve polimerizasyonun ilerlemesi ile reaksiyon hızının arttığı görülür. Hızdaki bu artış ortamın artan vizkozitesinden kaynaklanır. Bu olaya Jel Olayı (Trommsdorf veya Norrish-Smith olayı) denir. Reaksiyon hızındaki artış ile birlikte artışla birlikte polimerin mol tartısında da artış meydana gelir. Jel olayı yüksek dönüşümlerde sonlanma hız sabitlerinin küçülmesi sonucu ortaya çıkar. Aşağıdaki tabloda 22.5 \rm ^oC de metil metakrilatın polimerizasyonu sırasında \rm k_p ve \rm k_t büyüklükleri verilmiştir.
Polimerizasyonun başlama ve ilerleme aşamalarında yalnızca monomerin aktif merkeze erişmesi gerektiğinden diffüzyon kontrollü değildir. Sonlanma basamağında ise iki polimer iki polimer zincirinin önce yan yana gelmesi zorunludur. Daha sonra bu iki zincirin aktif uçları karşı karşıya gelerek tepkimeyi gerçekleştirmesi gerekir. Jel olayı ile birlikte ortamın vizkozitesinin yükselmesiyle birlikte aktif merkezlerin karşı karşıya gelmesi veya sonlanmaların gerçekleşmesi zorlaşır. Yandaki şekilde polimetilmetakrilatın özivmeli polimerizasyonu görülüyor.
|