Spektral Geçişler ve Geçiş KurallarıBir elektron bir orbitalden bir başka orbitale geçerken yayılan radyasyonun dalgaboyunun \rm \Delta E = h \nu eşitliğinden hesaplanabileceğini daha önce söylemiştik. Ancak elektronların geçişleri sırasında bazı yasaklanmış durumlar söz konusudur. Bir elektron için spektral geçiş kuralları, atomik enerji seviyeleri arasında geçiş yaparken izin verilen veya yasaklanan durumları belirler. Bu kurallar, elektronların bir enerji seviyesinden diğerine geçiş yaparken hangi durumların gerçekleşebileceğini açıklar. Açısal Momentum Seçim Kuralı Bu kural, bir elektronun enerji seviyeleri arasında geçiş yaparken açısal momentumunun nasıl değiştiğini belirler.
Bu kural, bir elektronun geçişi sırasında orbital açısal momentum kuantum sayısının
yalnızca 1 birim değişebileceğini belirtir ( \rm \Delta l = \pm 1 ).
Yani, l kuantum sayısı bir seviye atlayarak artmalı veya azalmalıdır.
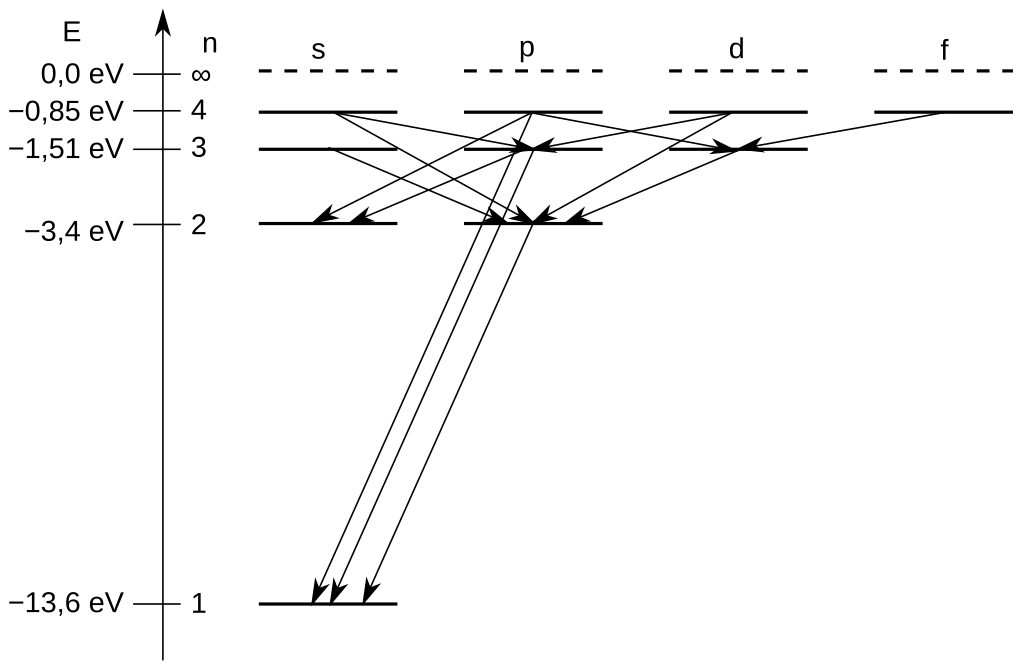
Bu kural, bir geçişin elektrik dipol geçişi olup olmadığını belirler. Toplam Açısal Momentum Seçim Kuralı (J) Bir atomun toplam açısal momentum kuantum sayısı J ile belirtilir. Elektronlar enerji seviyeleri arasında geçiş yaparken toplam açısal momentumda değişiklik olabilir: Ancak, başlangıç ve bitiş durumlarının her ikisi de J=0 olamaz ( \rm J=0, \pm 1). Bu kural, toplam açısal momentumun geçiş sırasında nasıl değiştiğini belirler. Yani .. J kuantum sayısı 0, 1 birim artabilir veya azalabilir. Spin Seçim Kuralı Bu kural, spin kuantum sayısının geçiş sırasında değişmeyeceğini ifade eder. Yani, bir geçiş sırasında elektronların toplam spin durumu sabit kalmalıdır ( \rm \Delta s =0 ). Hidrojenik atomlar için geçiş kuralları \rm \Delta l = \pm 1 , \Delta m_l = 0, \pm 1 dir. Bu geçişler Grotrian diagramı ile verilir.
|